普通化學/分子間鍵

共價鍵可以是極性的或非極性的,整個化合物也可能是極性的或非極性的,這取決於它的形狀。當一個鍵是極性的,它就會產生一個偶極,即一對電荷(一個正電荷,一個負電荷)。如果它們以對稱的形狀排列,使得它們指向相反的方向,它們就會相互抵消。例如,由於甲烷 (CH4) 中的四個氫原子相互背離,因此沒有整體偶極,該分子是非極性的。然而,在氨 (NH3) 中,由於非鍵合電子對引起的非對稱性,氮原子上有一個負偶極。化合物的極性決定了它的分子間鍵合能力。
當一個分子具有線性、三角平面、四面體、三角雙錐或八面體形狀時,它將是非極性的。這些形狀沒有非鍵合孤對。(例如,甲烷,CH4)但如果一些鍵是極性的而另一些鍵是非極性的,將會有一個整體偶極,分子將是極性的(例如,氯仿,CHCl3)。
其他形狀(有非鍵合對)將是極性的。(例如,水,H2O)除非,當然,所有共價鍵都是非極性的,在這種情況下,一開始就不會有偶極。
當兩個極性分子彼此靠近時,它們將以負極和正極排列的方式排列。將存在一種吸引力將這兩個分子結合在一起,但它遠不如分子內鍵強大。這是許多型別的分子結合在一起形成大型固體或液體的方式。
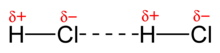
某些化學物質在其化學式中含有氫,它們具有特殊的分子間鍵型別,稱為氫鍵。當氫原子連線到氧、氮或氟原子時,就會發生氫鍵。這是因為氫和氟、氧和氮之間存在較大的電負性差異。因此,諸如、、 是極性非常強的分子,具有非常強的偶極-偶極力。由於氟、氧和氮的高電負性,這些元素幾乎完全從氫中拉走了電子。氫變成一個裸露的質子,從分子中伸出來,它將強烈地吸引任何其他極性分子的負極。氫鍵是偶極-偶極鍵的一種極端型別。這些力比分子內鍵弱,但比其他分子間力強得多,導致這些化合物的沸點很高。


二氧化矽形成一個共價網路。與二氧化碳(具有雙鍵)不同,二氧化矽僅形成單共價鍵。因此,單個分子以共價鍵方式鍵合到一個大型網路中。這些鍵非常強(是共價鍵),並且單個分子與整個網路之間沒有區別。共價網路將金剛石結合在一起。金剛石完全由碳組成,煤煙也是如此。與煤煙不同,金剛石具有共價網路,這使得它們非常堅硬且結晶。
範德華力或倫敦色散力是由電子位置不平衡時產生的臨時偶極引起的。電子不斷地圍繞原子核執行,偶然情況下它們可能會聚集在一起。電子濃度的不均勻會導致原子的某一側比另一側帶負電,從而產生一個臨時偶極。當原子中有更多電子,並且電子層離原子核更遠時,這些力會變得更強。
範德華力解釋了為什麼氮氣可以液化。氮氣是雙原子的,其化學式為 N2。由於這兩個原子具有相同的電負性,因此沒有偶極,分子是非極性的。如果沒有偶極,是什麼讓氮原子結合在一起形成液體呢?範德華力是答案。它們允許原本是非極性分子的分子之間存在吸引力。這些力是迄今為止將分子結合在一起的最弱的力。
在比較兩種物質時,可能會問及它們的熔點和沸點。為了確定哪種物質具有更高的熔點或沸點,你必須判斷哪種物質具有更強的分子間作用力。金屬鍵、離子鍵和共價網路非常強,因為它們實際上是分子內作用力。這些物質具有最高的熔點和沸點,因為只有當這些強大的鍵斷裂時,它們才會分離成單個分子。破壞這些分子內作用力需要大量的熱能。
具有氫鍵(一種分子間作用力)的物質將具有比具有普通偶極-偶極分子內作用力的物質更高的熔點和沸點。非極性分子具有最低的熔點和沸點,因為它們由弱的範德華力結合在一起。
如果你需要比較兩種金屬的沸點,那麼原子半徑更大的金屬將具有更弱的鍵合,因為電荷濃度較低。當比較非極性氣體(如稀有氣體)的沸點時,半徑最大的氣體將具有最高的沸點,因為它具有最大的範德華力潛力。
可以使用庫侖定律比較離子化合物。尋找具有高離子電荷和低離子半徑的物質。



