普通化學/分子形狀
共價分子透過電子對與其他原子鍵合。由於電子對帶負電荷,它們相互排斥,並試圖儘可能遠離彼此以穩定分子。這種排斥導致共價分子具有獨特的形狀,稱為分子的分子幾何形狀。有幾種不同的方法可以確定分子幾何形狀。一種稱為 VSEPR(價層電子對互斥)模型的科學模型可用於定性預測分子形狀。在這個模型中,AXE 方法用於透過計算與分子中心原子(s)相關的電子和鍵的數量來確定分子幾何形狀。
VSEPR 模型絕不是分子形狀的完美模型!它只是一個系統,它解釋了透過實驗發現的已知分子幾何形狀。這可以讓我們預測類似分子的幾何形狀,使其成為一個相當有用的模型。現代定量計算分子最穩定(最低能量)形狀的方法可能需要數小時的超級計算機時間,是計算化學的領域。
| 軌道雜化 | |||||
|---|---|---|---|---|---|
| sp |
sp2 | sp3 | sp3d | sp3d2 | |
| 2 組 | 線性 | 彎曲 | 彎曲 | 線性 | |
| 3 組 | 三角平面 | 三角錐形 | T 型 | ||
| 4 組 | 四面體 | 蹺蹺板形 | 平面正方形 | ||
| 5 組 | 三角雙錐 | 四方錐形 | |||
| 6 組 | 八面體 | ||||
雜化由連線到中心原子的“事物”的數量決定。這些“事物”可以是其他原子或非鍵合電子對。基團數是指連線到中心原子的原子或電子對的數量。例如,甲烷 (CH4) 是四面體形的,因為碳連線到四個氫。然而,氨 (NH3) 不是三角平面形的。它是三角錐形的,因為它連線到四個“事物”:三個氫和一個非鍵合電子對(以滿足氮的八隅體規則)。
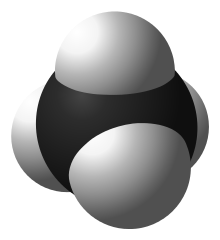
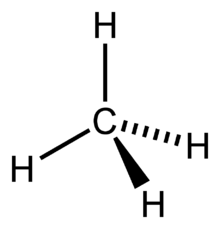
考慮一個簡單的共價分子甲烷 (CH4)。四個氫原子在三維空間中圍繞一個碳原子。每個 CH 鍵包含一對電子,這些電子對試圖儘可能遠離彼此(由於靜電排斥)。您可能認為這會導致扁平的形狀,每個氫原子相隔 90°。然而,在三維空間中,氫原子的排列更加有效。如果每個氫原子位於以碳原子為中心的四面體的頂點,它們之間的距離約為 cos-1(-1/3) ≈ 109.5°—這是可能的最大值。
為了將四個軌道排列成這種四面體形狀,需要將一個 s 軌道和三個 p 軌道重組成一個 sp3 軌道。
VSEPR 模型以類似於鍵合電子的方式處理孤對電子。例如,在氨 (NH3) 中,中心氮原子周圍有三個氫原子和一對孤對電子。因為有四個基團,氨具有四面體形狀,但與甲烷不同的是,氫原子之間的角度略小,為 107.3°。這可以透過理論解釋,即孤對電子在物理上比鍵合電子佔據的空間更大。這是一個合理的理論:在一個鍵中,電子對分佈在兩個原子之間,而孤對電子只位於一個原子之上。由於孤對電子更大,它迫使其他電子對更靠近。

用水測試這個假設提供了進一步的證據。在水 (H2O) 中,有兩個氫原子和兩對孤對電子,總共構成四個基團。電子對相互排斥形成四面體形狀。氫原子之間的角度為 104.5°,這與我們的模型預期相符。兩對孤對電子都將鍵推得更靠近,導致角度小於氨。
在某些分子中,價電子對少於四對。這發生在硼和鈹等電子缺陷原子中,它們不符合八隅體規則(它們分別可以有 6 個和 4 個價電子)。在三氟化硼 (BF3) 中,只有三對電子相互排斥形成一個平面。每個氟原子之間的距離為 cos-1(-1/2) = 120°。在這個分子中形成了一組不同的雜化軌道:2s 軌道和兩個 2p 軌道結合形成三個sp2 雜化軌道。剩餘的 p 軌道是空的,位於分子的平面之上和之下。
另一方面,鈹只形成兩對價電子。它們以 cos-1(-1) = 180° 的角度相互排斥,形成一個線性分子。一個例子是氯化鈹,它有兩個氯原子位於鈹原子的相對兩側。這次,一個 2s 軌道和一個 2p 軌道結合形成兩個sp 雜化軌道。兩個剩餘的 p 軌道位於鈹原子的上方和一側(它們是空的)。


有些元素會呈現彎曲形狀,而另一些元素則呈線性形狀。兩者都連線到兩個基團上,因此取決於中心原子有多少個孤對電子。
以二氧化硫(SO2)和二氧化碳(CO2)為例。兩者都具有兩個透過雙共價鍵連線的氧原子。二氧化碳是線性的,而二氧化硫是彎曲的。差異在於它們的價電子層。碳具有四個價電子,而硫具有六個。當它們成鍵時,碳沒有孤對電子,而硫有一個。
回想一下,某些元素,尤其是硫和磷,可以與五個或六個基團成鍵。雜化分別為sp3d或sp3d2,形狀分別為三角雙錐或八面體。當存在孤對電子時,就會出現其他形狀(見上表)。
黃色基團代表孤對電子。白色基團代表鍵合原子,粉色代表中心原子。這被稱為AXE方法;A是中心原子,X是鍵合原子,E是孤對電子。
-
線性
-
平面三角形
-
彎曲
-
四面體
-
三角錐體
-
彎曲
-
三角雙錐
-
蹺蹺板形
-
T形
-
八面體
-
四方錐體
-
平面正方形