普通化學/離子鍵
離子是帶電的原子或分子。陽離子帶正電,陰離子帶負電。當原子獲得或失去電子時,就會形成離子。由於電子帶負電,失去一個或多個電子的原子會帶正電;獲得一個或多個電子的原子會帶負電。
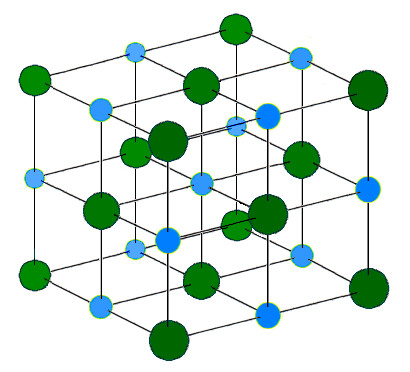
離子鍵是帶正電和帶負電的離子之間的吸引力。這些帶相反電荷的離子相互吸引,形成離子網路(或晶格)。靜電解釋了為什麼會出現這種情況:異性相吸,同性相斥。當許多離子相互吸引時,它們會形成大而有序的晶格,其中每個離子都被相反電荷的離子包圍。通常,當金屬與非金屬反應時,電子從金屬轉移到非金屬(這是因為金屬傾向於具有相對較低的電離能,而非金屬傾向於具有較高的電子親和能)。金屬形成帶正電荷的離子,而非金屬形成帶負電荷的離子。離子化合物的最小單元是化學式單元,但這個單元僅僅反映了導致整個晶體中性化的離子比例,例如 NaCl 或 MgCl2。在結構中無法區分單個 NaCl 或 MgCl2 分子。
然而,堆疊可能包含像硝酸銨中的 NH4+ 和 NO3- 這樣的分子離子。在這樣的結構中,離子是帶電荷的分子而不是帶電荷的原子。
 |
 |
離子鍵也可以稱為電價鍵。
離子化合物示例:氯化鈉 (),硝酸鉀 ().
離子鍵合物質通常具有以下特徵。
- 高熔點(在室溫下為固體)
- 堅硬但易碎(會碎裂)
- 許多溶解在水中
- 溶解或熔化時可導電
一般來說,保持晶格結合在一起的力取決於它所包含的離子的電荷乘積。例如,將 NaCl (+1)*(-1) 與 MgO (+2)*(-2) 進行比較表明,氧化鎂比氯化鈉結合得更牢固,大約是它的 4 倍。這就是為什麼氯化鈉的熔點比氧化鎂低得多,也比氧化鎂更容易溶解在水這樣的溶劑中。

大多數離子化合物可溶於極性溶劑。極性溶劑只是那些分子具有正負極的溶劑。最常見的極性溶劑例子是水 (H2O)。
它們可溶於極性溶劑的原因是,正離子被溶劑的負極吸引,負離子被溶劑的正極吸引。因此,離子化合物在溶劑中解離或分離成其組成離子。
例如,H2O 由相對更正的氫原子和相對更負的氧原子組成。當像NaCl這樣的離子化合物被新增到水中時,正離子會被更負的氧原子吸引,負離子會被更正的氫原子吸引。
這是許多離子化合物非常有用的性質,但並非全部,因為有一些例外,某些化合物無法溶解在某些極性溶劑中。
為了使物質導電,必須有一些電荷載體。例如,在金屬中,傳輸電荷的是圍繞正離子的移動電子。
然而,在固態下,離子化合物缺乏任何能夠攜帶電荷的移動粒子,因為保持它們固定在位的靜電力非常強,離子無法在晶格內移動。當化合物溶解或熔化時,這種情況會發生變化。當溶解時,離子會解離,並能夠四處移動。熔融離子化合物也是如此。這就是為什麼熔融和溶解的離子化合物可以導電,而固態離子化合物不能導電。

當金屬和非金屬發生化學反應時,就會形成離子鍵。由於金屬的電離能較低,失去電子形成完整的價電子層後,不會變得非常不穩定,並帶正電。而由於非金屬的電子親和力較大,獲得電子形成完整的價電子層後,會變得非常穩定,並帶負電。當金屬和非金屬反應時,金屬會失去電子,並將電子轉移給非金屬,非金屬則會獲得電子。整個過程 - 少量的損失加上大量的獲得 - 導致能量的淨降低。因此,會形成離子,這些離子會立即相互吸引,從而形成離子鍵。
例如,在鈉(Na)和氯(Cl)的反應中,每個Cl原子從Na原子中獲得一個電子。因此,每個Na變成Na+陽離子,而每個Cl原子變成Cl-陰離子。由於它們帶相反的電荷,它們相互吸引,並與數百萬個其他離子結合形成離子晶格。這種大規模集體堆疊產生的晶格能進一步穩定了新化合物。晶格中的化學式(正負離子的比例)是**NaCl**,即正負電荷數相等,從而保證了中性。
電荷必須保持平衡,否則大部分電荷之間的排斥力將變得難以克服。在氯化鎂的情況下,鎂原子會釋放兩個電子以變得穩定。請注意,它位於第二族,因此有兩個價電子。氯原子只能接受一個電子,因此每個鎂離子必須有兩個氯離子。因此,氯化鎂的化學式為**MgCl2**。如果形成氧化鎂,其化學式將為**MgO**,因為氧可以接受鎂的兩個電子。
還需要注意的是,一些原子可以形成多種離子。這通常發生在過渡金屬中。例如,鐵(Fe)可以變成Fe2+(稱為亞鐵),II)或 - 使用舊的名稱 - 亞鐵。Fe也可以變成Fe3+(稱為鐵),III)或 - 有時仍然 - ferric。
常見離子
[edit | edit source]離子鍵通常發生在金屬和非金屬之間的反應中,但也存在一些稱為多原子離子的分子,它們也會發生離子鍵。在這些多原子離子中,可能存在共價鍵(或極性鍵),但作為一個整體,它們會發生離子鍵。存在無數的多原子離子,但你應該熟悉最常見的那些。建議你記住這些離子。
| 名稱 | 化學式 | 名稱 | 化學式 |
|---|---|---|---|
| 銨 | NH4+ | 水合氫離子 | H3O+ |
| 過氧化物 | O22- | 氫氧根 | OH- |
| 亞硝酸根 | NO2- | 硝酸根 | NO3- |
| 亞硫酸根 | SO32- | 硫酸根 | SO42- |
| 亞硫酸氫根 | HSO3- | 磷酸根 | PO43- |
| 次氯酸根 | ClO- | 亞氯酸根 | ClO2- |
| 氯酸根 | ClO3- | 高氯酸根 | ClO4- |
| 碳酸根 | CO32- | 碳酸氫根 | HCO3- |


