普通化學/電子層和軌道
每個電子層都細分為亞層,亞層由軌道組成,每個軌道上的電子具有不同的角動量。每個亞層中的軌道都有一個特徵形狀,並用字母命名。它們是:s、p、d 和 f。在一個單電子原子(如 H、He+、Li+2 等)中,特定電子層內每個軌道的能量是相同的。然而,當存在多個電子時,它們會相互作用並使軌道分裂成略微不同的能量。字母 s、p、d 和 f 指定了亞層(角量子數 l),軌道由磁量子數 m 指定。角量子數和磁量子數分別與電子的角動量的幅度和方向有關。在任何特定亞層中,軌道的能量取決於 s、p、d 和 f 軌道的角動量,按照從最低到最高的能量順序排列。
此影像顯示了軌道(以及用於鍵合的雜化軌道和一個樣本電子構型,將在後面解釋)。 
原子中最簡單的亞層是 1s 亞層。它沒有徑向或角節點:1s 亞層只是一個電子密度的球體。節點是電子位置機率為零的點。與所有亞層一樣,徑向節點的數量隨著主量子數的增加而增加(即 2s 軌道有一個徑向節點,3s 有兩個,依此類推)。因為角動量量子數是 0,所以磁量子數只有一個選擇 - 每個電子層只有一個 s 軌道。s 軌道可以容納兩個電子,只要它們具有不同的自旋量子數。s 軌道參與鍵合。
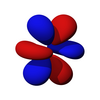
從第二層開始,有一組 p 亞層。限制在 p 亞層中的電子的角動量量子數是 1,因此每個軌道都具有一個角節點。磁量子數有 3 個選擇,這表明有 3 個不同方向的 p 亞層。最後,每個軌道可以容納兩個電子(自旋相反),使 p 軌道總容量為 6 個電子。
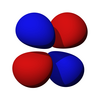
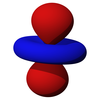
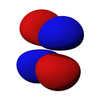
p 亞層的軌道都具有沿著每個軸指向的兩個電子密度瓣。每個軌道沿其軸是對稱的。p 亞層的軌道符號表明它指向哪個軸,例如,px 沿 x 軸指向,py 沿 y 軸指向,pz 沿 z 軸上下指向。請注意,雖然 pz 對應於 ml = 0 軌道,但 px 和 py 實際上是 ml = -1 和 ml = 1 軌道的混合物。p 軌道是簡併的 - 它們都具有相同的能量。p 軌道經常參與鍵合。
| 2px | 2py | 2pz |
|---|---|---|

|

|

|
第一組 d 軌道是 3d 組。角動量量子數是 2,因此每個軌道都有兩個角節點。磁量子數有 5 個選擇,這導致 5 個不同的 d 軌道。每個軌道可以容納兩個電子(自旋相反),使 d 軌道總容量為 10 個電子。
需要注意的是,除了dz2軌道有兩個相對的瓣和一個環狀的電子密度外,所有d軌道都有四個電子密度瓣。d軌道可以進一步細分為兩個子集。dx2-y2和dz2軌道都直接指向x,y和z軸,形成一個**eg**子集。另一方面,dxy,dxz和dyz軌道的瓣都排列在象限中,在軸上沒有電子密度。這三個軌道形成一個**t2g**子集。在大多數情況下,d軌道是**簡併的**,但有時它們會分裂,eg和t2g子集會有不同的能量。**晶體場理論**預測並解釋了這一現象。d軌道有時參與成鍵,特別是在無機化學中。

|
|
|
|

|
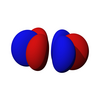
f 子層
[edit | edit source]第一組f軌道是4f子層。有7個可能的磁量子數,所以有7個f軌道。它們的形狀相當複雜,在化學學習中很少出現。由於每個軌道可以容納兩個電子(自旋相反),所以有14個f電子。
|

|

|

|
|

|

|




