普通化學/量子原子
這四個數字用於描述原子中電子的位置。
| 編號 | 符號 | 可能的值 |
|---|---|---|
| 主量子數 | ||
| 角動量量子數 | ||
| 磁量子數 | ||
| 自旋量子數 |
決定電子所在的電子層。電子層是決定電子能量的主要因素(n 越高,能量越高),以及軌道的大小,對應於最大核距離(n 越高,距離原子核越遠)。元素在週期表中所處的行數決定了電子層數。氦 (n = 1)、氖 (n = 2)、氬 (n = 3) 等。請注意,電子層將具有不同的編號,如上表所述;例如,氬將包含 、 和 亞層,總共 3 個。
角動量量子數 (l)
[edit | edit source]也稱為方位量子數。決定電子所在的亞層。每個亞層都有獨特的形狀和字母名稱。s 軌道呈球形,當 l = 0 時出現。p 軌道(有三個)呈淚滴形,當 l = 1 時出現。d 軌道(有五個)當 l = 2 時出現。f 軌道(有七個)當 l = 3 時出現。(順便說一句,當 l = 4 時,軌道為“g 軌道”,但它們(以及 l = 5 的“h 軌道”)在普通化學中可以安全地忽略)。可以使用主量子數計算每個電子層中亞層數,如下所示。 例如,在 電子層中,亞層為一個 亞層和 3 個 亞層。您將在下一節學習如何確定每個亞層的軌道數。
該數字還提供了關於軌道角節點的資訊。一個節點定義為 駐波 上波幅最小的點。當應用於化學時,這是零位移點,因此沒有電子存在。反過來,角節點是指沒有電子存在或沒有電子密度的平面或錐形表面。此頁面上顯示的模型顯示了這些軌道的最簡單表示及其節點。更準確但更復雜的描述對於本書的範圍來說沒有必要。
以下是軌道的圖片。請記住,它們不顯示電子的實際路徑,因為存在海森堡不確定性原理。相反,它們顯示了電子最有可能出現的體積,即機率振幅 最大。兩種顏色代表波函式 的兩個符號(相位)(選擇是任意的)。每個描繪的軌道都是兩個相反m 量子數(見下文)的疊加。
| ml | 0 | -1 和 1 | -2 和 2 | -3 和 3 |
|---|---|---|---|---|
| S 軌道 → | 
|
|||
| P 軌道 → | 
|
 
|
||
| D 軌道 → | 
|
 
|
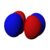 
|
|
| F 軌道 → | 
|
 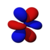
|
 
|
 
|
磁量子數 (ml)
[edit | edit source]| ml | -3 | -2 | -1 | 0 | 1 | 2 | 3 |
|---|---|---|---|---|---|---|---|
| S 軌道 → | 
|
||||||
| P 軌道 → | 
|

|

|
||||
| D 軌道 → | 
|

|

|

|

|
||
| F 軌道 → | 
|

|

|

|

|

|

|
磁量子數決定電子所在的軌道。每個亞層的軌道數可以按如下方式計算: 。ml 決定複雜相位圍繞 z 軸增加的速度。在沒有磁場的情況下,這些軌道都具有相同的能量,它們是簡併的,可以組合成不同的形狀和空間方向。亞層中簡併的軌道稱為簡併軌道。這僅僅意味著每個 p 亞層中的軌道都具有相同的能級。更高 亞層的形狀和方向差異在普通化學中並不重要,並且在同一個更高 亞層中的軌道無論形狀差異如何仍然是簡併的。
自旋量子數 (ms)
[edit | edit source]它並不決定電子的自旋。 +½對應於電子構型框中的向上箭頭。如果一個軌道中只有一個電子(一個框中只有一個箭頭),那麼它總是被認為是 +½。第二個箭頭,或者向下箭頭,被認為是 -½。每個軌道可以包含一個“自旋向上”電子和一個“自旋向下”電子。
讓我們檢查一下鎂原子 12Mg 中電子的量子數。記住,每個數字列表對應於 (n, l, ml, ms)。
| 兩個 s 電子 | (1, 0, 0, +½) | (1, 0, 0, -½) | ||||
| 兩個 s 電子 | (2, 0, 0, +½) | (2, 0, 0, -½) | ||||
| 六個 p 電子 | (2, 1, -1, +½) | (2, 1, -1, -½) | (2, 1, 0, +½) | (2, 1, 0, -½) | (2, 1, 1, +½) | (2, 1, 1, -½) |
| 兩個 s 電子 | (3, 0, 0, +½) | (3, 0, 0, -½) |
注意元素週期表上的規律。不同的區域或塊,有不同型別的電子。最左側的兩列構成 s 區。最右側的六列構成 p 區。中間的較大區域(過渡金屬)構成 d 區。底部部分構成 f 區(鑭系和錒系)。每一行引入了一個新的電子層(又稱能級)。基本上,行告訴你會有多少個電子層,而列告訴你將出現哪些亞層(以及它們出現在哪些層)。ml 的值可以透過我們將在下一章學習的一些規則來確定。ms 的值並不重要,只要在同一個軌道中沒有重複的值。
為了更好地瞭解這種規律,請檢視這個元素週期表。 |

















