結構生物化學/細胞訊號通路/蛋白激酶訊號級聯
蛋白激酶不是可以磷酸化其他蛋白以賦予蛋白編碼的酶。這些編碼指示細胞執行工作,例如分裂或生長。磷酸化是啟用或失活酶的常見方法,因此蛋白激酶通常存在於訊號通路中。高達 30% 的所有人類蛋白都透過磷酸化修飾,這使得激酶在細胞調節中極其重要。由於一個激酶分子可以作用於許多蛋白,因此啟用激酶的效果會放大目標蛋白啟用的數量。如果激酶作為訊號通路的一部分作用於另一個激酶,則啟用激酶的效果會放大數倍,從而導致訊號級聯。級聯可以透過蛋白磷酸酶移除磷酸基團來停止[1]。
在生活中可以看到一個訊號級聯的例子,它重塑細胞外基質,導致腫瘤細胞干預。肝素酶新增到訊號級聯中,導致特定蛋白激酶的磷酸化增加,並由於基因轉錄增加而產生腫瘤。
激酶和磷酸酶都受複雜訊號通路的調節。訊號級聯開始時激酶的啟用可以來自幾個來源,包括環狀腺苷單磷酸(cAMP)和鈣調蛋白。cAMP 的釋放是由腎上腺素等激素啟用的。
-
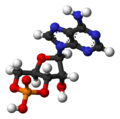
環狀腺苷單磷酸
-
環狀腺苷單磷酸
-
鈣調蛋白 3D 結構
例如:cAMP 與 PKA(蛋白激酶 A)的調節亞基結合會解除其對催化亞基的抑制。簡而言之,cAMP 啟用激酶。
激酶通常透過將 ATP 分子與待修飾的蛋白在疏水口袋中結合在一起,以排除水。然後將磷酸基團從 ATP 轉移到待啟用蛋白上的氨基酸。磷酸化通常發生在絲氨酸的羥基、蘇氨酸或酪氨酸上,但也有一些激酶作用於其他氨基酸,例如組氨酸、天冬氨酸和谷氨醯胺。在訊號級聯中,新啟用的蛋白也可能是一種激酶,然後可以磷酸化其他蛋白。
磷酸基團的結合可以透過兩種方式影響蛋白的活性。磷酸化可以透過引起蛋白構象變化來直接影響活性。或者,磷酸化的氨基酸可以被特定蛋白或其他底物識別並結合[2]。羧基末端包含一個磷酸酪氨酸殘基,它可以與 SH2 結構域接觸。此外,SH2 結構域和激酶結構域由 SH3 結構域結合。在這種情況下,激酶處於其非活性構象。該蛋白可以透過三個基本步驟啟用:1. 與 SH2 口袋結合的磷酸酪氨酸殘基可以被具有更高親和力的多肽取代,該多肽對該 SH2 結構域具有更高親和力。2. 在酪氨酸中,磷酸基團可以被磷酸酶去除,最後 3. 連線體可以被具有更高親和力的多肽從 SH3 結構域中取代。
已經被蛋白激酶磷酸化的蛋白可以透過蛋白磷酸酶去磷酸化。磷酸酶引入水以水解磷酸二酯鍵,釋放去磷酸化蛋白和正磷酸。當初始觸發訊號分子消失時,例如當激素被分解時,整個訊號級聯停止。一些級聯是自終止的,因為啟用的激酶會磷酸化催化觸發分子分解的酶,例如 cAMP 的情況。
由於激酶可以迅速導致細胞發生非常大的變化,因為訊號被放大,所以它們的活性受到嚴格的調節。許多激酶本身受磷酸化的控制,一些激酶會自身磷酸化,這個過程稱為順式磷酸化或自磷酸化。激酶調節的其他方法包括抑制蛋白或啟用蛋白或小分子的結合,以及控制它們在細胞內的位置。
有絲分裂原活化蛋白激酶(或 MAP 激酶)眾所周知在使卵母細胞保持停滯狀態直到受精中發揮重要作用。科學家認為 MAP 激酶訊號傳導是細胞間通訊流中非常重要的一個。在哺乳動物卵子中,卵子在減數分裂的第二次中期停止,活性 MAP 激酶會阻止卵子在受精後完成減數分裂。與其他蛋白激酶一樣,它將磷酸基團從 ATP 轉移到受體蛋白上的絲氨酸、蘇氨酸或酪氨酸氨基酸上。這種磷酸化會改變其靶蛋白的活性和功能。MAP 激酶會磷酸化多種胞質蛋白和轉錄因子,這些蛋白和轉錄因子會執行酶的下游效應。MAP 激酶受另一種稱為 MEK 的蛋白激酶的調節,MEK 會特異性地磷酸化 MAP 激酶氨基酸鏈中的 Thr 202 和 Tyr 204,並開啟 MAP 激酶的蛋白激酶活性。MAP 激酶的其他功能包括指示未成熟細胞如何成長為專門的細胞型別或如何死亡。由於它們是許多重要細胞過程的關鍵,許多研究人員希望將它們用作藥物的良好靶點。
顯然,MAP 激酶對環境平衡的幾乎任何變化都會被啟用,其調節對維持機體的健康至關重要。MAP 激酶訊號傳導錯誤會導致代謝綜合徵和 2 型糖尿病等併發症。代謝綜合徵是用來描述代謝過程中各種干擾的副作用的術語,例如胰島素抵抗和肥胖。
應激啟用蛋白激酶 (SAPK) 訊號通路負責調節細胞對環境變化的反應,例如發育、轉化、炎症和物理應激。SAPK 通路與 MAPK 通路相似,因為它們具有共同的特徵,例如底物特異性和雙重磷酸化。SAPK 訊號通路的調節不當可能會導致心血管疾病等併發症。