結構生物化學/焓
在特定溫度和壓強下的反應焓定義為反應物在恆溫恆壓條件下轉化為產物時系統與周圍環境之間交換的熱量。流入系統的熱量用正號表示。此外,標準生成焓是指在 1 巴壓強下指定反應的一摩爾生成焓。“焓”這個詞及其準確定義直到 1840 年代後期才出現。在此之前,科學家和工程師透過經驗得知,當兩個物體接觸時,一種稱為熱的流體從較熱物體轉移到較冷物體。結果是,冷物體變熱,熱物體變冷,因為熱量在它們之間轉移。焓也是反應物在恆壓下轉化為產物時吸收或釋放的熱能。當焓為負時,熱能被釋放。然而,當焓為正時,反應物從周圍環境中吸收熱量。
一個合理的觀點是,有一些東西從熱物體轉移到冷物體。這個“東西”被稱為熱量。因此,說熱量總是從較高溫度流向較低溫度很方便。這個結論確立了溫度梯度的概念,可以看作是能量作為熱量傳遞的驅動力。後來,透過進行更精確的測量和實驗,科學家得出結論,熱量從一個物體傳遞到另一個物體的速率與兩個物體之間的溫差成正比。因此,當兩個物體之間的溫差可忽略不計時,熱量傳遞可忽略不計。
從熱力學的角度來看,熱量(或在熱物體和冷物體之間傳遞的能量)永遠不會被認為是儲存在物體中的。從這個角度來看,熱量僅在能量從一個物體轉移到另一個物體時才存在;或者用熱力學術語來說,從系統到周圍環境。當熱量新增到系統或其周圍環境中或從系統或其周圍環境中減去時,人們認為能量沒有被儲存在接觸點或被拉離接觸點。相反,人們認為熱量充當動能和勢能。加減過程被認為是從勢能到動能的轉移,反之亦然。
儘管熱量具有瞬態特性,但熱量的定義始終被視為正在測量的物體的獨特屬性。如上所述,溫度變化被用作測量熱量的主要單位,直到 1840 年代後期。事實上,熱量單位的定義是基於單位質量水的溫度變化,如英國熱量單位所示。英國熱量單位通常被稱為 Btu。
英國熱量單位定義為將 1/180 的熱量傳遞到一公斤質量的水中,使其在標準大氣壓下從 0 攝氏度升高到 100 攝氏度。這種熱量的原始定義未能提供準確的測量。造成這種不準確的主要原因在於參考物體,在本例中為水。測量的溫度變化部分取決於水的純度。水越純,溫度升高一度所需的熱量就越多。
在 20 世紀,越來越多的科學家意識到,熱量只是另一種形式的能量,透過兩個物體的接觸而轉移。因此,用能量單位測量熱量既方便又實用。
焓或熱量的現代概念主要是基於詹姆斯·普雷斯科特·焦耳 (1818-1889) 進行的一系列實驗。焦耳的實驗涉及在絕緣容器中仔細測量的水、油和汞的量。他在容器中放入已知量的上述物質,並用旋轉攪拌器攪拌這些流體。進行旋轉所需的機械功被仔細計算,並且流體溫度的變化被精確測量。焦耳在他的結果中指出,對於每種流體,每單位質量每升高一度溫度所需的機械功是固定的。此外,可以透過與較冷物體接觸來簡單地傳遞熱量來恢復流體的原始溫度。因此,焦耳的實驗牢固地確立了熱量與功之間的定量關係,它明確證明了熱量是一種能量形式。
為了給熱量一個更具體的定義,更重要的是,為了認識到所有能量單位的共同基礎,國際蒸汽表卡路里被定義為與焦耳(能量的 SI 單位)相關。焦耳是在一牛頓力的作用下沿一米距離做的機械功。在建立 SI 單位後,國際蒸汽表卡路里被定義為等效於 4.1868 焦耳(精確定義),熱化學卡路里被定義為等效於 4.184 焦耳(精確定義)。作為參考,一個國際蒸汽表 Btu 等效於 1055.056 焦耳,一個熱化學 Btu 等效於 1054.35 焦耳。
焓 (H) 是衡量反應熱能的一種方法。一個熱力學系統的焓 H,其內能、壓強和體積分別為 U、P 和 V,定義為 H =U+PV。由於 U、P 和 V 是狀態函式,因此 H 是狀態函式。從 dw=-PdV 注意到 P 和 V 的乘積具有功的量綱,因此具有能量的量綱。因此,將 U 和 PV 加在一起是合理的。自然地,H 具有能量單位。
例如,一個放熱反應的焓變為負。這是因為產物的焓小於反應物的焓。
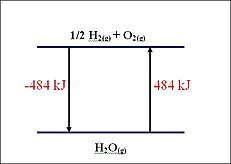
用數學術語來說,反應的焓可以表示為以下形式
ΔH =(斷裂鍵的總和)-(形成鍵的總和)
ΔH = ΣnH產物 - ΣnH反應物
當 ΔH 為負時,反應為放熱,形成的鍵比斷裂的鍵更多。
如果 ΔH 為正,則反應為吸熱。化學鍵傾向於自發形成,ΔH 的負值代表放熱反應。
逆反應的焓在大小上相等,但在數學符號上相反。
焓是一個狀態函式,因此根據蓋斯定律,反應的總焓等於可以將總反應分解的各個反應或步驟的焓之和。
由於焓是為計算目的而定義的函式,因此很難測量物質的實際焓。然而,焓變很容易測量,並且是許多計算中的一個重要量。
當焓發生變化時,表示系統中發生了狀態變化。但焓是可逆的,因為物理狀態變化通常是可逆的。因此,由於所有物質的生成焓總是給定的,那麼在任何給定的變化中,都可以計算出新的焓。
Slonczewski, Joan L. . 微生物學“一項不斷發展的科學”。第二版。
Smith, J.M. (2005). 化學工程熱力學導論. McGraw Hill. ISBN 978-007-127055-7. {{cite book}}: Text "coauthors+ H.C. Van Ness, M.M. Abbott" ignored (help)
Engel, Thomas. 物理化學。第三版。
