結構生物化學/脂類/膜流動性
流動鑲嵌模型最初由 S. Jonathan Singer 和 Garth Nicolson 於 1972 年提出。他們對該模型的設想是展示和描述生物膜的一般結構。生物膜由脂雙層組成,本質上是由脂類和蛋白質組成的二維溶液。脂雙層既作為整合蛋白的溶劑,也作為滲透屏障。
為了分解模型名稱的各個部分:模型的流動性基於疏水性成分,如蛋白質和脂類。這兩種成分使膜能夠具有流動性,因為它不是固體;它不是隻由一種型別的生物大分子組成。模型名稱中的鑲嵌部分是基於這樣的事實,即鑲嵌是由不同的碎片組成的,從而得到一幅整體影像。鑲嵌模型不僅僅包含一種型別的完整成分,而是包含多種(例如糖蛋白或磷脂)。由於模型是由不同的碎片組成的,因此它形成了鑲嵌,因此得名。
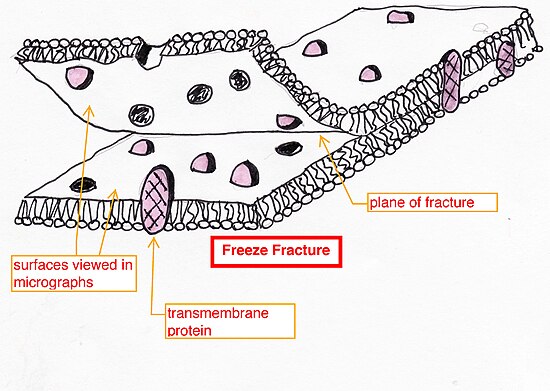
流動鑲嵌模型的一個方面是,膜蛋白由於其流動性(側向擴散)而隨機分佈在膜平面上。這是使用電子顯微鏡觀察透過冷凍斷裂切割的脂雙層來驗證的。
該技術的總體概述如下
1. 將細胞冷凍在液氮中。
2. 使用刀片將冷凍細胞斷裂。斷裂發生在薄弱的部位,例如質膜的脂雙層之間。
3. 冷凍蝕刻使用真空去除表面冰。
4. 製作複製品的第一個步驟是用鉑蒸汽以 45 度角對錶面進行陰影處理。
5. 製作複製品的下一個步驟是將一層非常薄的碳蒸發到表面上,角度為 90 度。
6. 透過用酸或鹼降解有機細胞材料來顯露最終的複製品。
7. 然後在電子顯微鏡下研究碳-鉑複製品,陰影隕石坑和凸起顯示了膜蛋白的模式。
冷凍斷裂(以及金屬陰影和透過電子顯微鏡成像)是一種可以用來視覺化膜結構和蛋白質分佈的技術。首先,將細胞迅速冷凍在液氮中。然後,它沿斷裂平面裂開,該平面將脂雙層分開。沿此平面分離會暴露嵌入膜中的蛋白質。斷裂後,兩個部分都塗上/陰影處理金屬,如鉑。接下來使用酸溶解有機材料,從而產生樣品表面的複製品。然後在電子顯微鏡下觀察複製品。顯微照片顯示樣品表面有凸起,實際上是跨膜蛋白,因為樣品一半的表面對應於磷脂雙層的內表面。這證實了膜蛋白隨機分散在磷脂雙層中,並且存在跨越整個膜的整合跨膜蛋白。
技術和結果顯微照片的示例
側向擴散是指膜中發現的脂類和蛋白質的側向運動。如果膜脂類和蛋白質沒有受到某些相互作用的限制,它們通常可以自由側向移動。側向擴散是一個相當快速且自發的過程。在此運動中,膽固醇分子在結構域內移動。
側向擴散可以透過稱為光漂白後熒光恢復 (FRAP) 的過程來追蹤。該過程可行,因為使用熒游標記可以追蹤分子。首先用生色團標記細胞表面,然後在熒光顯微鏡下對一個部分(照明區域)進行分析。在這個特定部位,熒光分子透過漂白(使用雷射)來破壞,並觀察它們是否離開或進入照明區域。如果分子是移動的,它有兩個不同的狀態,漂白或未漂白。如果分子離開照明區域,這意味著分子被漂白了。如果分子進入照明區域,這意味著分子未被漂白。未漂白的分子有助於提高熒光強度。
側向擴散還可以透過一種互補策略來測量,該策略被稱為光漂白後熒光損失 (FLIP)。在這種技術中,一個小區域被持續漂白,並且熒光蛋白在擴散到其中時被漂白。最終,熒光蛋白的數量會減少,並導致所有蛋白都被漂白。從 FRAP 和 FLIP 兩者中,我們都可以根據漂白蛋白計算擴散係數。
儘管這兩種技術似乎很有希望,但它也有一些缺點。一個問題是無法觀察到每種蛋白質的單個運動,因為有太多漂白/熒光蛋白。例如,無法判斷每種蛋白質是靜止的,還是僅限於一個小區域,也許是由於細胞骨架的阻礙。為了解決這個問題,可以使用一種稱為單粒子追蹤的技術。在這種技術中,單個蛋白質由抗體標記,並用熒光染料或少量金點染色。這些蛋白質的運動然後透過影片顯微鏡記錄下來。使用這種技術可以定期觀察蛋白質的擴散途徑。
橫向擴散或翻轉涉及脂類或蛋白質從一個膜表面移動到另一個膜表面。與側向擴散不同,橫向擴散是一個相當緩慢的過程,因為翻轉發生需要相當多的能量。大多數大型蛋白質不會翻轉,因為它們具有廣泛的極性區域,這些區域在膜雙層的疏水核心是不利的。這使得膜的不對稱效能夠長時間保持,這是細胞調節的一個重要方面。
在許多細胞中,將有蛋白質成分來幫助“翻轉”過程。這可以透過比較人造脂雙層與天然雙層的翻轉速率來觀察。人造脂雙層的翻轉速率非常緩慢,與天然雙層相比可以忽略不計,表明天然雙層中存在某種物質來幫助“翻轉”過程。生物膜中磷脂的翻轉速率遠大於人工脂膜中的翻轉速率,因為生物膜具有蛋白質成分,如翻轉酶和磷脂易位酶,這些成分可以加速磷脂從雙層一側移動到另一側的速率。
膜的流動性決定了分子透過膜的運輸程度和訊號轉導的程度。膜流動性與其 **脂肪酸** 和 **膽固醇** 含量有關。脂肪酸鏈可以是有序且剛性的,也可以是無序且流動的,這會影響它們所處的膜的流動性。長的脂肪酸鏈能夠形成更強的分子間相互作用,從而限制了流動性。由於不飽和 *順式* 和 *反式* 雙鍵形成的脂肪酸鏈中的彎曲和扭結可能會干擾分子間相互作用,從而促進流動性。因此,可以透過改變雙鍵數量和脂肪酸鏈長度來控制膜流動性。同時,膜中存在大量的膽固醇分子會限制流動性。
膽固醇是動物膜流動性的關鍵調節劑。它能夠與磷脂相互作用並形成特定的複合物,稱為脂筏,這些脂筏集中在膜的特定區域。脂筏導致膜流動性的調節,使膜流動性降低,同時使其不易發生相變。膽固醇由一個甾體組成,一端連線有 -OH 羥基,另一端連線有烴鏈。甾體的環和烴鏈能夠插入膜的磷脂雙層中,並參與疏水性相互作用,而極性羥基則與周圍磷脂的極性頭部基團相互作用。
膜的 **熔點** 可以用來確定流動性的程度。隨著溫度升高,膜會從剛性狀態急劇轉變為更流動的狀態。低熔點表明存在促進流動性的脂肪酸,而高熔點表明存在限制流動性的脂肪酸和膽固醇。
熔點也會受到分子自身堆積能力的影響。飽和度、雙鍵(*順式* 或 *反式*)和脂肪酸鏈長度等特性都會影響熔點。比較飽和與不飽和時,飽和脂肪酸的熔點會更高,因為殘基會相互反應,導致脂肪酸處於更剛性的狀態。雙鍵的特定型別也會影響熔點。*順式* 雙鍵的熔點比 *反式* 雙鍵低,因為它們不能像 *反式* 雙鍵那樣很好地堆積成晶體;因此,具有順式雙鍵的脂肪更容易從固相進入液相。較長的脂肪酸鏈具有較高的熔點,因為與較短的鏈相比,它們需要斷裂更多的鍵。鍵越多,熔點越高。
在流體鑲嵌模型被開發時,蛋白質可以在膜中表現出橫向移動的想法是一個相對較新的想法。最早測試這一想法的實驗之一是由 L. Frye 和 M. Edidin 完成的。人細胞和小鼠細胞融合在一起,並使用熒游標記抗體來觀察每種型別的整合膜蛋白是否可以在融合細胞中兩種型別的膜之間移動。羅丹明,一種紅色熒游標記,用於標記針對人蛋白的特異性抗體,綠色標記熒光素用於標記針對小鼠細胞蛋白的特異性抗體。新融合的小鼠/人細胞暴露於兩種抗體,產生的結合模式表明融合細胞沒有被分成一半紅色邊和一半綠色邊,而是具有綠色和紅色標記的蛋白/抗體的混合內容。這表明在短時間內,融合細胞中的整合蛋白會分散,因此膜蛋白具有快速橫向流動性。
"細胞的分子生物學。" 第五版 - Alberts,Johnson,Lewis,Raff,Roberts,Walter
Lefers,Mark。冷凍斷裂技術。西北大學生物學詞彙。2009 年 11 月 17 日
http://www.biochem.northwestern.edu/holmgren/Glossary/index.html
https://wikibook.tw/wiki/Structural_Biochemistry/Lipids/Fluid_Mosaic_Model
https://wikibook.tw/wiki/Structural_Biochemistry/Lipids/Lipid_Bilayer
https://wikibook.tw/wiki/Structural_Biochemistry/Lipids/Membrane_Lipids
https://wikibook.tw/wiki/Structural_Biochemistry/Lipids/Fatty_Acids
https://wikibook.tw/wiki/Structural_Biochemistry/Lipids/Cholesterol