結構生物化學/膜蛋白
膜蛋白是任何在生物膜中發現的蛋白質。它們參與各種生物過程,例如細胞訊號轉導途徑。膜蛋白在控制各種梯度方面也起著重要作用,例如化學梯度、電梯度和機械梯度,並在細胞分裂等關鍵細胞事件中負責細胞結構。由於它們在膜中的多種功能,它們在膜表面高度集中。它們也可以作為通道,將特定分子進出膜。這些蛋白質根據蛋白質與膜相互作用的強度分為兩大類。
以下列出了兩大類:
- 整合蛋白:(也稱為內在蛋白)這些蛋白質的特徵是與膜的強相互作用,這種相互作用只能透過新增去垢劑或其他非極性溶劑來破壞。從本質上講,它們永久地與膜結合。它們可以跨越整個磷脂雙分子層,也可以是單拓撲的。

整合蛋白。 - 外周蛋白:(或外在蛋白)是與膜相互作用比整合蛋白弱得多的蛋白質。這些連線往往更暫時,可以透過用極性試劑處理來置換。
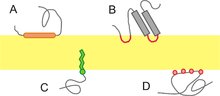
外周蛋白。
還有一種膜蛋白的分類方法。它來自膜蛋白,例如 colicin A 和 α-溶血素。這些蛋白不適合整合或外周分類。在這個分類的替代系統中,膜蛋白分為整合蛋白和兩親蛋白。

生物膜具有磷脂雙分子層結構,其中包含一組蛋白質,這些蛋白質幫助質膜執行其獨特的功能。膜蛋白可以附著到細胞或細胞器的膜上,或與之相關。膜蛋白可以根據它們與膜結合強度的不同分為兩組
一些膜蛋白被發現結合到脂質雙分子層上,通常參與細胞間訊號傳遞或相互作用。另一些則嵌入細胞的脂質雙分子層中,通常形成通道和孔隙。膜蛋白可以附著在細胞膜的外部和內部。
蛋白質可以透過多種方式附著到細胞膜上。一種方法涉及不可逆的共價修飾。Ras(一種 GTP 酶)和 Src(蛋白質酪氨酸激酶)都已知以這種方式被修飾。這兩種蛋白質都參與訊號轉導途徑,但當共價連線脂質基團時,它們就會附著到細胞質膜的內表面。當 Ras 和 Src 固定到細胞膜時,它們能夠更好地接收和傳遞透過其各自的訊號轉導途徑傳遞的資訊。膜蛋白可以由α螺旋或β摺疊組成,也可以由α螺旋和β摺疊的組合組成。例如,稱為孔蛋白的通道蛋白完全由β摺疊構成,而稱為前列腺素的酶蛋白完全由α螺旋構成。
膜蛋白可以是α-螺旋或β-摺疊。蛋白質可以透過α螺旋跨越膜。跨膜α-螺旋是膜蛋白中最常見的結構基序。對一級結構的檢查表明,膜蛋白中大多數氨基酸是非極性的,極少是帶電的。發現的第一個 α-蛋白質之一是細菌視紫紅質。它利用光能將質子從細胞內部轉運到外部,從而產生用於形成 ATP 的質子梯度。七個α-螺旋緊密堆積,排列垂直於細胞平面,跨越 45A 寬度。膜蛋白也可以由β摺疊構成。β摺疊形成通道蛋白。它們不如α-螺旋常見。通道蛋白是由β摺疊的β摺疊排列形成的。每條鏈與其相鄰鏈以反平行排列形成氫鍵,形成一個單一的β摺疊。然後 β摺疊捲曲形成一個空心圓柱體,在膜中形成一個通道。一個例子是孔蛋白。外表面是非極性的,與膜的烴鏈核心相互作用,而內部通道是親水的,充滿水。極性和非極性排列是透過沿每條β摺疊交替疏水和親水氨基酸來實現的。
許多膜蛋白具有由多個亞基組成的四級結構。膜蛋白中的這種寡聚化有利於其功能、穩定性、遺傳效率,甚至可能最佳化膜單位面積的生產力。細胞色素 b6f 作為四級結構影響膜蛋白功能的一個例子。這種蛋白質包含兩個亞基,它們透過一個橋連線在一起,以便電子可以在它們之間轉移。關於穩定性,如果在一個亞基上發生穩定性改善的突變,則由 2、3 或 4 個亞基組成的四級蛋白質將分別穩定 2、3 或 4 倍。對所有四級蛋白亞基由 1 個基因編碼,而不是每個亞基由不同的基因編碼,這在遺傳上將更有效。透過這種方式,可以以最小的遺傳空間編碼四級蛋白。這方面的一個例子是跨膜的離子通道。這些四級膜蛋白的整體是由重複的、相同的亞基堆疊在一起形成的。然後,每個亞基(以及因此整個離子通道)都由 1 個單一基因編碼並翻譯而來。此外,寡聚化還可以有助於最大限度地提高功能輸出,因為它允許膜蛋白緊密地堆積在脂質雙分子層區域內,而不會以能量不利的方式與其他蛋白質接觸。[1]
在許多癌細胞中觀察到 Ras 和 Src 的突變;據認為,這些突變以及隨後的訊號轉導途徑中斷會導致細胞不受控制的複製。當檢測到突變的存在時,一種名為泛素的小蛋白質會附著在受損的蛋白質上;這種修飾表明標記的蛋白質將被破壞。重要的是在後期之前破壞蛋白質,這樣受損的 DNA 不會傳遞給其他細胞。泛素附著在受損蛋白質上是細胞凋亡(程式性細胞死亡)的第一步。[編輯] 整合蛋白
如前所述,整合蛋白(也稱為內在蛋白)與膜牢固地結合並永久結合。這些蛋白質的一個或多個部分嵌入膜的磷脂雙分子層中。它們表現出與膜的強烈相互作用,因為它們的氨基酸殘基包含疏水側鏈,這些側鏈與磷脂雙分子層的疏水內部(脂肪醯基)相互作用。由於它們與膜的疏水核心的強烈疏水相互作用,因此這些蛋白質只能使用去垢劑、非極性溶劑或有時是變性劑從膜中分離出來。最後,重要的是要注意,整合蛋白佔基因組中編碼的蛋白質的很大一部分。
整合蛋白有兩大基本類別。
這些蛋白質跨越整個膜。它們是整合蛋白中最常見的。

它們可以只穿過膜一次或多次,在膜中穿梭。跨膜蛋白有兩種型別:α-螺旋和β-桶。
前者是兩者中更為常見的,可以在細菌細胞的內膜或真核生物的質膜中找到。電壓門控離子通道,如鉀通道和氯通道,是α-螺旋跨膜蛋白的例子。它們主要由疏水性氨基酸殘基組成,很少有親水性殘基,例如帶電和極性殘基。主鏈中的極性羰基氧不向螺旋外突出,而是指向內部,促進和加強螺旋內的氫鍵。範德華力將跨膜區域的三級和四級結構連線在一起。這些相互作用允許結構的靈活性以適應必要的功能。在 TM 主鏈中發現的最常見的兩種極性殘基是絲氨酸和蘇氨酸,它們可能與螺旋主鍊形成氫鍵。這種氫鍵作用將極性側鏈捕獲在疏水環境中,例如脂質雙層。極性側鏈反過來又與其他螺旋形成氫鍵。兩種殘基,甘氨酸和脯氨酸,被稱為水中的螺旋破壞者,它們在螺旋中形成摺痕,在功能機制中起著重要的作用。[2]
β-桶存在於革蘭氏陰性菌的外膜、革蘭氏陽性菌的細胞壁、線粒體和葉綠體的外膜中。孔蛋白是β-桶跨膜蛋白的例子。它們穿過細胞膜,充當分子可以擴散的孔道。跨膜蛋白可以進一步分類為 I 型和 II 型。在 I 型中,N 末端位於膜的外側。在 II 型中,C 末端出現在膜的外側。

VDAC(電壓依賴性陰離子通道)是線粒體外膜中發現的一種跨膜蛋白的例子,它為底物擴散提供孔道。VDAC 由 19 個 β-摺疊組成,形成 β-桶,以及一個部分 α-螺旋鏈,在該單元中共有 20 個鏈。β-桶的第一個和最後一個 β-摺疊是平行的,而中間的摺疊是反平行的。[3]
VDAC 的亞型 1,事實上,在去汙劑膠束和雙層體中的三個高解析度結構最近已從溶液核磁共振和 X 射線晶體學中發表。這有助於解決 VDAC 的膜拓撲結構,並提供第一個真核 β-桶膜蛋白結構。這種跨膜蛋白的不同之處在於它具有平行 β-摺疊配對和奇數個摺疊。研究為 VDAC 的電壓門控機制及其受 NADH 調節提供了結構和功能基礎。自 VDAC-1 的從頭結構和另外六種蛋白質以來,過去兩年中透過溶液核磁共振發現的跨膜蛋白結構數量已翻了一番。[4]
單拓撲蛋白
[edit | edit source]這些蛋白質永久地與膜結合,但僅從一側結合。許多這些蛋白質是酶。例如,環氧合酶和肉鹼 O-棕櫚醯轉移酶。前者是一種參與前列腺素形成的酶。阿司匹林和布洛芬等抗炎藥透過抑制這種酶來緩解炎症和疼痛的症狀。後者是一種線粒體轉移酶,參與棕櫚醯肉鹼代謝為棕櫚醯輔酶 A。
外周蛋白
[edit | edit source]外周蛋白,也稱為外在蛋白,缺乏與磷脂雙層的疏水內部的相互作用。由於它們缺乏與膜的疏水相互作用,因此它們比整合蛋白更容易從膜上分離。外周蛋白的解離可以透過用高 pH 或高鹽濃度溶液處理來實現。相反,外周蛋白透過靜電和其他非共價力附著在膜上。通常,它們要麼透過與整合蛋白相互作用間接附著在膜上,要麼透過與磷脂的極性頭部(兩親性)直接相互作用。一些外周蛋白表現出這兩種型別的相互作用。這些包括某些激酶和 G 蛋白。外周蛋白的其他例子是離子通道和跨膜受體的調節蛋白亞基。膜蛋白功能
轉運蛋白
[edit | edit source]由於脂質雙層的性質,許多分子由於尺寸或電荷而無法進入或離開細胞。膜蛋白的功能是幫助這些分子穿過脂質雙層。跨膜蛋白參與被動運輸或主動運輸。
泛素和膜蛋白轉運
[edit | edit source]ER 插入脂質雙層會導致新合成的跨膜蛋白被分類、轉移和定性維持。這個過程由泛素化控制,泛素化是一種蛋白質翻譯後修飾,與蛋白質生物合成遞送至質膜有關。可以透過分泌途徑跟蹤此過程。泛素化還可以用來調節透過內吞途徑從質膜中刪除蛋白質。跨膜蛋白的泛素化通常足以將質膜蛋白內吞靶向。但是,仍然存在某些功能,例如分類和降解,這些功能完全需要泛素。
這種對特定膜蛋白的控制和改變是由於泛素改變了整合膜蛋白的質量或數量。作為副作用,該過程中的缺陷也會導致諸如囊性纖維化等有害疾病。
泛素修飾可以影響貨物運輸、分泌/內吞途徑中質量控制/維護機制。
泛素在內質網膜轉運和質量控制中的作用
[edit | edit source]泛素轉化不會影響 ER 預先執行的調節作用。然而,在內質網相關降解過程或 ERAD 中,泛素活性會在泛素連線酶的需要下啟動。此過程很重要,因為它負責去除未正確摺疊的蛋白質。接受此過程的底物被重新定位到細胞質中,等待被去除。ERAD 靶點首先被泛素化,並且必須與蛋白質 Ubx(一種泛素結合蛋白)協商。此過程表明,ERAD 底物的泛素化提供了一個訊號,該訊號對於將蛋白質靶向降解是必需的。這表明泛素在蛋白質膜蛋白轉運中起著至關重要的作用。重要的是要注意,ERAD 功能還提供了關鍵的質量保證方面。此過程中的一個錯誤可能會導致有害的副作用;這意味著 ERAD 程式經過仔細監控,因此可以確保膜蛋白的轉移質量。
泛素在蛋白質質量控制中調節蛋白質膜蛋白組成
[edit | edit source]發現 ERAD 可以影響和加強 ER 和高爾基體之間的通訊。這可以透過降解 ER 的保留因子來實現。在膽固醇耗竭條件下,細胞被泛素化並降解。這表明蛋白質離開 ER 並被送入高爾基體進行包裝。相反,高爾基體中的 GAT 蛋白包含三個可以很好地結合泛素的表面。這導致泛素成功結合,並加速了 GAT 蛋白從高爾基體轉移到 ER。此外,聚合蛋白貨物和泛素為蛋白質膜的定位提供了必要的驅動力。
泛素在質膜蛋白週轉中的作用
[edit | edit source]在酵母的內吞作用中,泛素幾乎是所有過程所必需的。酵母內有足夠的泛素供應是有益的。酵母中存在的蛋白質貨物的內化通常都是泛素介導的。
質膜蛋白包含一種由蛋白質自身因素驅動的保護機制。質膜也限制了錯誤摺疊蛋白質的數量。在生命週期中,質膜蛋白會對錯誤摺疊蛋白質的數量進行限制和調節。這種質量檢查表明,這些特定的蛋白質必須控制膜整合蛋白以及受損和錯誤構建蛋白的去除。儘管對化學過程的理解有限,但質量維護機制通常必須包括以下功能:修復或重新摺疊受損蛋白質的能力,以及區分健康和受損蛋白質的能力。
與細胞質或水性環境中的蛋白質一樣,蛋白水解過程對細胞質和脂雙層中的細胞功能至關重要。然而,膜內蛋白酶與水溶性蛋白質相比,面臨著不同的挑戰。科學家一直在研究方法來破譯膜內蛋白酶家族的分子機制。特別是,Site-2 膜內金屬蛋白酶和絲氨酸膜內蛋白酶 rhomboid 具有共同的特徵。這兩個蛋白酶家族的活性位點都位於膜中。然而,為了有效切割膜蛋白或任何其他蛋白質,必須引入水來水解肽鍵。這些蛋白酶通常識別特定的殘基序列,從而在特定位點切割蛋白質。為了將水引入切割位點,存在一個將水性環境連線到切割位點的遞送系統。
分子被允許沿著濃度梯度流動。在大多數情況下,這不需要特殊的蛋白質。然而,在協助擴散中,不溶於脂雙層或太大而無法透過的分子透過特殊的轉運蛋白的協助穿過細胞膜。協助擴散的例子包括氨基酸和離子。

其他型別的被動運輸,不需要蛋白質,因為分子直接透過細胞膜擴散,包括滲透、擴散和過濾。

單向轉運蛋白是在被動運輸中移動分子的蛋白質。它們可以是通道蛋白或載體蛋白。通道蛋白響應刺激開啟,並讓分子自由地流過。載體蛋白與分子結合,使其具有足夠的疏水性以穿過膜。下圖顯示了兩種型別的單向轉運蛋白及其功能。
能量被消耗來將分子向上運輸穿過濃度梯度。主動運輸有兩種型別:初級主動運輸和次級主動運輸。兩者都涉及利用 ATP 逆濃度梯度運輸,但它們在蛋白質如何使用 ATP 上有所不同。
ATP 被消耗來將分子向上運輸穿過濃度梯度。一個例子是鈉鉀泵,它將兩種離子都逆濃度梯度泵出,以產生膜電壓勢。
在次級主動運輸中,ATP 沒有直接與目標分子偶聯。相反,另一個分子被向上運輸穿過濃度梯度,從而產生一個電化學梯度。然後,目標分子沿著電化學梯度被運輸。雖然這個過程仍然消耗 ATP 來產生梯度,但能量沒有直接用於將分子跨膜移動,因此被稱為次級主動運輸。
次級主動運輸中涉及兩種主要的蛋白質型別:反向轉運蛋白 和 協同轉運蛋白.
- 反向轉運蛋白
- 分子在相反方向移動。一種型別的分子進入細胞,而另一種型別的分子離開細胞。一個例子是鈉鈣交換蛋白,它從細胞中移除鈣離子,同時允許鈉離子返回。鈉離子被鈉鉀泵泵出,從而產生這種過程所需的濃度梯度。
- 協同轉運蛋白
- 分子在相同方向移動。這通常透過允許離子沿著其電化學梯度移動來實現。另一個分子搭載這種移動並逆其濃度梯度移動。
膜蛋白的流動性 生物膜是柔性的。這種柔性是透過蛋白質的流動性實現的。流體鑲嵌模型允許稱為橫向擴散的橫向運動,有時也會發生橫向擴散或翻轉,這需要更長的時間。
橫向擴散 是脂類橫向移動,速度很快,除非受到特殊相互作用的限制。

翻轉或 橫向擴散 是指分子從一個膜表面過渡到另一個膜表面的情況。與橫向擴散相比,它是一個非常慢的過程。每隔幾個小時才會發生一次。
儘管在膜蛋白的研究方面取得了許多進展,但人們對環境在決定膜蛋白結構或功能方面的作用知之甚少,因為這些蛋白質很容易受到環境變化的影響。主要問題仍然在於難以創造一個促進蛋白質天然功能和結構的環境。然而,對流感病毒,更具體地說對 M2 蛋白的研究進展,為這一複雜挑戰提供了更多見解。
M2 蛋白是一種同四聚體,具有三個功能域:N 末端、TM 螺旋和 C 末端。在最近的發現之前,藥物有效地阻斷了 TM 螺旋,從而阻止了質子傳導功能,進而使病毒失活。然而,隨著最近 H1N1 病毒和豬流感暴發的發生,該蛋白質的結構在三種不同的環境中被仔細研究,每種環境使用不同的方法。透過比較這三種獲得的結果,可以觀察到環境對蛋白質的影響。第一種成像技術,固態核磁共振,得出結論,M2 在脂雙層環境中是穩定的。後來添加了藥物金剛烷胺,使蛋白質呈現四重對稱結構,進一步表明在金剛烷胺存在的情況下更穩定。
第二種影像,晶體結構,不僅比較了不同 pH 值下的結構,而且還表明膜蛋白可以獲得一系列構象狀態。
最後,由溶液核磁共振生成的第三種影像得出結論,膜蛋白的氨基酸相互作用以最小化靜電勢,並且當存在水時,允許氫鍵交換。對該蛋白質的進一步篩選仍在進行中,在環境對蛋白質結構的影響的研究中,還有很多東西有待揭示。然而,很容易理解為什麼這個話題仍然是一個重要且受歡迎的話題。通過了解環境對膜蛋白的影響,研究人員能夠開發藥物來抑制,例如,流感病毒。即使是 H1N1 病毒等突變也能被停用,只要研究人員對它們的膜蛋白以及它們如何被環境改變和操縱有關鍵的理解。對 M2 蛋白的研究最終將導致對其他膜蛋白以及它們如何被環境變化改變有更深入的瞭解。
膜在人體中起著最重要的作用。它強烈地影響著每個結構環境。每當我們談論膜時,我們必須提及蛋白質結構,因為它們相互關聯。蛋白質也被稱為氨基酸,在我們的身體中發揮作用。膜和氨基酸是人體中幫助我們保持生命的主要功能。它們相互支援,在身體內部的每個部位形成正確的結構和序列。
人體記憶體在不同型別的膜,每種膜都具有不同的結構和功能,這些結構和功能也與氨基酸相關。例如,跨膜蛋白存在於異質環境中,這對現有結構方法構成了重大障礙。每種結構可以在不同的環境中發揮作用,並且鍵的連線方式也不同。很難獲得支援膜蛋白的天然結構、動態和功能的膜模擬環境。膜蛋白通常需要使用去垢劑來模擬天然脂雙層環境。為了成功瞭解它們在哪個環境中發揮作用,我們必須瞭解鍵的結構。鍵在每種結構中都非常重要,因為它將元素和一個或多個結構連線在一起。但是,瞭解如何斷裂鍵和形成新鍵也很重要。這就是了解鍵角和鍵穩定性非常有幫助的原因。此外,通過了解鍵結構,科學家可以研究不同型別的疾病以及治癒所有疾病的藥物。脂雙層是一種薄膜。脂雙層在表徵膜蛋白的天然結構和驗證在其他膜模擬環境中確定的結構方面具有獨特的作用。
事實上,許多蛋白質是膜蛋白,它們在細胞中發揮作用。細胞需要與外部環境進行交流或穿過細胞膜。許多進入膜的蛋白質是與糖蛋白相關的。蛋白質很難研究,因為它們的結構和功能非常複雜。然而,一些蛋白質的功能是可以預測的。
膜蛋白的研究一直受到 X 射線晶體學難以檢測這些蛋白質的困擾。到目前為止,科學家們已經能夠透過對膜中蛋白質進行計算模擬來研究膜成分之間的相互作用細節及其相對功能。膜蛋白穩定性的問題困擾著科學家們。一項特別困難的任務涉及研究不同狀態之間的可逆轉變。這些相互作用已經過熱力學研究,併產生了關於螺旋-螺旋相互作用和膜蛋白穩定性方法型別的相關資訊。蛋白質和脂質之間的穩定性已透過模擬方法進行模擬,例如模擬將特定氨基酸側鏈埋入雙層中的自由能成本。原子模擬使得這些努力成為可能,包括揭示關於複雜膜蛋白(如離子通道)的資訊。
研究膜蛋白的困難主要歸因於處理蛋白質的困難以及與膜蛋白工作相關的實驗挑戰。此外,為了對系統有適當的理解,對孤立的蛋白質分子和分子環境進行共同研究使得研究變得更加困難。例如,從生物系統中剩餘成分中分離蛋白質對於結構測定至關重要。但為了進行任何適當的熱力學分析,它必須包含系統的所有相關成分,尤其要注意能量交換的邊界。
傳統上,在研究膜蛋白時,科學家會在製備過程中去除膜蛋白周圍的脂質。現在,科學家們認識到脂質作為結晶的重要新增劑的重要性。目前,科學家們在分析過程中新增脂質後,在解決膜蛋白結構方面取得了更大的成功。這些成功導致越來越多的膜蛋白結構與脂質分子結合變得清晰可見,並可以進行分類。
膜蛋白複合物
[edit | edit source]膜蛋白組裝成複合物,這些複合物允許這些錯綜複雜的組裝實現使用單一多肽無法實現的複雜性。這些複雜的組裝允許膜蛋白具有許多涉及調節機制和化學反應的功能。這些膜蛋白複合物的存在可以防止潛在的問題,例如不必要的相互作用、聚集或有害中間體的形成。此外,這些複合物在機械上是寶貴的,因為它們遵循一個過程,其中複合物的一部分是“預製的”,並且在損壞時被單獨替換,這意味著如果只有一個亞基損壞,則不需要替換整個複合物。膜蛋白複合物已透過藍原生聚丙烯醯胺凝膠電泳和分裂泛素方法進行了分析。
膜蛋白複合物允許透過以有序的、甚至順序的方式組裝來避免上述問題(不必要的相互作用、聚集或有害中間體的形成)。為了瞭解這些複合物的形成是有序的,需要知道組裝中間體是什麼。因此,蛋白質越大,越難暴露形成順序。然而,較小的複合物,如大腸桿菌 bo3 複合物,使科學家能夠理解膜蛋白複合物遵循線性的組裝路徑。bo3 複合物由四個亞基組成,這些亞基透過兩個中間複合物組裝而成。人們理解 bo3 線性組裝是因為雖然可能形成其他中間體導致 bo3 的形成,但它們沒有被觀察到,並且只存在一條組裝路徑,表明中間體遵循順序的有序路徑。非線性組裝將是顯而易見的,因為將存在幾種不同的組裝路徑。有序形成在細胞分裂中的分裂體中也可見,如果缺少一種蛋白質,所有下游蛋白質將無法正常相互作用。科學家認為,這種有序途徑的存在是為了保護細胞免受潛在有害中間體的傷害。
伴侶蛋白在這些複合物的形成中也發揮著重要作用。伴侶蛋白充當物理組裝因子,與蛋白質相互作用並防止發生非生產性的相互作用。例如,伴侶蛋白防止酵母 F1F0-ATP 合酶的 F1 複合物中發生聚集。與α和β亞基結合的兩個伴侶蛋白與疏水介面結合,並將α和β亞基引導到 a3b3 複合物組裝中。研究還表明,某些中間體中伴侶蛋白的缺失可能是膜蛋白複合物活化的原因。重要的是,中間體必須保持非活性狀態,以防止部分組裝的複合物發生不受調節的活性。
人們認為膜蛋白複合物會經歷動態交換,作為一種調節複合物內受損亞基的機制。動態交換允許將新匯入的蛋白質組裝到複合物中以替換受損的蛋白質,而無需替換整個複合物。這在光系統 II 葉綠體中可見,其 D1 亞基會受到光損傷,並作為其修復機制的一部分被替換。動態交換最初僅在體外進行。科學家只能得出結論,動態交換是一種可能的修復機制,但無法得出結論,它實際上是在體內發生的。直到使用熒光顯微鏡,科學家才能夠證實動態顯微鏡確實在一定程度上發生了。熒光顯微鏡標記了蛋白質並觀察了它在體內的相互作用。觀察到亞基自由擴散進入和離開復合物。未來的研究希望能揭示哪些蛋白質正在交換,以及為什麼這些蛋白質會經歷動態交換。[5]
在文章“膜蛋白結構:預測與現實”中,Arne Elofosson 和 Gunnar von Heijne 討論了目前用於預測膜蛋白插入和摺疊的幾種技術;他們對這些技術的使用方式和侷限性進行了現實而務實的描述。他們還指出了這些技術中尚未解決的主要問題。
Arne 和 Gunnar 首先指出α-螺旋束和β-桶是膜蛋白的兩種主要結構。雖然螺旋束約佔所有開放閱讀框的 20% 到 25%,但桶狀結構只佔所有開放閱讀框的百分比。一個開放閱讀框。(一個閱讀框指的是可以分成三個字母的密碼子並被轉錄成蛋白質的 DNA/RNA,而一個開放閱讀框指的是在閱讀框中不包含終止密碼子的 DNA 序列。)螺旋束和β-桶之間的相似之處在於,為了適應膜中脂雙層的基本結構,它們都在蛋白質的中間包含疏水性氨基酸。兩者之間的主要區別在於它們的二級結構。螺旋束是一種複雜的、長跨膜蛋白,它包含多個α-螺旋;而β-桶蛋白包含幾個β-摺疊捲起,它比α-螺旋束更短,疏水性更低。Arne 和 Gunnar 指出,螺旋束形式受到了更多的關注,因為它們更長,因此比β-桶更容易識別。
Arne 和 Gunnar 描述了螺旋束和 β 桶是如何合成並插入脂質雙層的。在螺旋束轉運的情況下,相應的核糖體首先與轉運蛋白結合,轉運蛋白是一種位於內膜的蛋白質,負責將蛋白質轉運穿過內細胞膜進入周質,稱為 SecYEG 轉運蛋白。螺旋束被翻譯並插入內膜。根據螺旋束的疏水性,螺旋束之間的相互作用會有所不同;一次可以合成一個螺旋束或多個螺旋束。β 桶由於其疏水性低於螺旋束,無法獨自穿過內膜;在細胞質中翻譯後,它在 SecA ATPase 的幫助下透過 SecYEG 轉運蛋白與 SecB 結合並轉移到周質。它透過 YaeT 異源寡聚體外膜整合複合物插入外膜。在膜蛋白插入脂質雙層後,人們認為螺旋束之間的相互作用比與脂質的相互作用更強,因此螺旋束相互緊密排列並獲得其構象。極性側鏈之間的氫鍵也參與了蛋白質的構象形成。螺旋束和 β 桶在插入膜後會達到相對穩定的構象。然而,一些膜蛋白表現出更高的靈活性,例如負責質子或電子轉移的那些。
根據 Arne 和 Gunnar 的說法,在螺旋束膜蛋白的情況下,一級結構,即其氨基酸序列長期以來被用來區分螺旋束膜蛋白和其他蛋白。由於脂質雙層具有疏水性,因此插入這種脂質雙層的螺旋束應該包含疏水殘基。兩種重要的氨基酸,色氨酸和酪氨酸,其側鏈含有芳香結構,有助於螺旋束膜蛋白的疏水性。螺旋束也必須足夠長才能跨越內膜;因此,一個螺旋束可以平均包含 10 到 20 個疏水殘基。環連線螺旋;根據環是面向細胞內部還是外部,環包含不同的氨基酸組成。
人們一直認為膜蛋白是垂直穿過膜的,Arne 和 Gunnar 指出,膜蛋白的方向可能更復雜。導致膜蛋白複雜性意外增加的一個因素是重入環,如穀氨酸轉運蛋白的情況所示。關於 β 桶,Arne 和 Gunnar 概括了一系列推斷出的結構原理;例如,β 摺疊具有偶數並以反平行方式傾斜約 45 度。
結構預測
[edit | edit source]Arne 和 Gunnar 調查了一系列拓撲結構和結構預測方案,其複雜性逐漸增加。二維預測是最早的技術;這種技術利用跨膜蛋白比環區更高的疏水性,並且一直是一種有效的工具。二維預測面臨的一個挑戰是,來自訊號肽和跨膜螺旋的拓撲基因資料相似,因此難以區分兩者。在預測 β 桶膜蛋白的結構時,科學家會尋找是否存在 N 末端訊號肽以及蛋白質的總體氨基酸組成。預測 β 桶膜蛋白的結構比預測螺旋束的結構更簡單,因為其氨基酸序列更短,而且不像那麼明顯。
如前所述,膜蛋白不能簡單地建模為全部垂直穿過膜;重入環是一個重要的特徵,它增加了膜蛋白的複雜性。Arne 和 Gunner 建議,這些重入環可以透過一種名為 2.5D 預測的最新開發的拓撲技術來預測。這些重入環中的殘基,包括長環、中長環和短環,通常比蛋白質的其他部分更小,因此很容易在跨膜螺旋之間找到。2.5D 膜蛋白結構預測基於蛋白質所包含的氨基酸序列型別或預測殘基距離膜蛋白中心的距離來預測結構。可以預測的殘基特徵包括脂質暴露(疏水)區域或脂質埋藏殘基以及脯氨酸引起的彎曲。由於 2.5D 預測能夠包含膜蛋白的亞結構,例如介面螺旋和重入環,因此它有助於對膜蛋白進行分類。
3D 結構預測最初是透過低解析度實驗(如電子顯微鏡)進行的。Arne 和 Gunnar 指出,與所有其他針對 3D 預測測試的球狀蛋白一樣,膜蛋白的 3D 預測精度較低。導致膜蛋白 3D 預測難度增加的原因是,它們在與球狀蛋白不同的環境中維持其結構;此外,已成功預測的球狀蛋白遠小於感興趣的膜蛋白。迄今為止,可用於測試的 3D 模型有限,但已經有一些模型被提議用於測試。其中之一是同源建模,這可能會導致具有原子水平細節的結構,其質量與針對球狀蛋白測試的模型相似。[6]
SNARE 蛋白
[edit | edit source]在 膜運輸中的未解之謎 這篇由斯坦福大學生物化學系 Susanne R. Pfeffer 撰寫的論文中,她解釋了關於蛋白質如何在細胞內穿梭並幫助促進運輸的不同假設,但目前還沒有完全得到證實的假設。首先,可溶性 N-乙基馬來醯亞胺敏感因子附著蛋白受體蛋白,也稱為 SNARE 蛋白,有助於促進囊泡與其目標膜的融合。SNARE 蛋白有兩組截然不同的型別。第一組是 R-SNARE,也稱為 v-SNARE 組,位於囊泡上。第二組 SNARE 蛋白是 Q-SNARE,也稱為 t-SNARE,因為它位於目標膜上。這兩類蛋白的主要區別在於,R-SNARE 在囊泡上只作為單個蛋白質存在,而 Q-SNARE 則會形成三個 Q-SNARE 的複合物。在這些類別下,特定的 R-SNARE 蛋白會與特定的 Q-蛋白配對。關於這兩者如何配對以促進高爾基體囊泡與細胞表面的融合,目前尚不清楚,但我們可以將其想象為 SNARE 蛋白就像拼圖一樣,因為它們具有特定的特異性,因此一個 SNARE 蛋白(R-SNARE/v-SNARE)將只與一個特定的 SNARE 複合物(Q-SNARE/t-SNARE)結合。儘管科學家仍然不知道高爾基體如何決定運輸這些囊泡,但 R-SNARE 和 Q-SNARE 為到達了什麼和可能離開了什麼提供了線索。如果某個特定位置存在 Q-SNARE 的濃度,則可以透過觀察該位置之前是否存在融合活動來解釋。現在,當我們觀察 R-SNARE 時,有兩種可能的答案解釋了它們為何存在於某個特定位置,一種可能是因為它們最近到達並且剛剛發生融合,另一種可能是因為一個囊泡即將離開高爾基體膜。需要注意的是,反式高爾基體中的膜運輸量小於順式高爾基體中的膜運輸量,這一點可以透過觀察反式高爾基體邊緣的 SNARE 濃度較低,而順式高爾基體邊緣的 SNARE 濃度較高來證明。因此,有了所有這些新想法,我們必須尋找具體的答案,以更好地理解細胞內的膜運輸是如何發生的。[7]
參考文獻
[edit | edit source]- ↑ http://www.ncbi.nlm.nih.gov/pubmed?term=Introduction%20to%20the%20membrane%20protein%20reviews%3A%20the%20interplay%20of%20structure%2C%20dynamics%2C%20and%20environment%20in%20membrane%20protein%20function
- ↑ NCBI, 溶劑化環境對膜蛋白結構的影響,2012 年 11 月 19 日
- ↑ Hiller, S., Abramson, J., Mannella, C., Wagner, G., and Zeth, K., "VDAC 的 3D 結構代表一種天然構象", Trends in Biochemical Sciences, 2010.
- ↑ 溶液 NMR 在 VDAC-1 和其他膜蛋白結構測定中的作用。Sebastian Hiller 和 Gerhard Wagner*
- ↑ 膜蛋白組裝成複合物,作者:Daniel O. Daleya,於斯德哥爾摩大學生物膜研究中心,生物化學與生物物理學系,瑞典斯德哥爾摩,郵編:106 91,2009 年 6 月 5 日。
- ↑ 膜蛋白結構:預測與現實。Annu Elofsson A, von Heijne G. Rev Biochem. 2007.76:125-40
- ↑ 膜運輸中的未解之謎:Annu. Rev. Biochem. 2007. 76:629–45 Pfeffer, Suzanne R. 斯坦福大學生物化學系
8. http://www.annualreviews.org/doi/pdf/10.1146/annurev-biochem-060210-093619


