結構生物化學/膜蛋白/離子通道
離子通道 是多孔的跨膜蛋白,透過允許離子沿著其電化學梯度透過孔隙擴散來幫助調節跨質膜的電壓梯度。它們都透過以圓形排列組裝的幾個蛋白質亞基來調節穿過質膜的離子流動,其中孔隙中最窄的區域只有幾個原子跨度。它們選擇性地允許離子透過尺寸或電荷擴散。其他離子通道可能像一個閘門一樣起作用,允許離子透過電、溫度或其他刺激透過。
環核苷酸通道,也稱為 cGMP 通道,是各種細胞(從神經元到精子細胞)的感官訊號傳導的關鍵。它們分為兩類:經典 cGMP 通道和 CNGK 和 mICNG 型通道。這兩類幫助啟用機制隨著時間的推移而進化。
cGMP 通道在跟蹤細胞內 cNMP(環核苷酸)濃度時產生電壓響應。環核苷酸[1]通道對 Ca2+ 離子具有滲透性,可以承載混合陽離子電流,因此能夠建立化學符號。由於這些特性,cGMP 通道在視網膜光感受器和嗅覺受體神經元的訊號通路中發揮重要作用。視網膜中的光感受器透過根據 cGMP(環鳥苷單磷酸)濃度開啟或關閉 cGMP 通道來響應光線和黑暗。
在光照下,cGMP 濃度低,光感受器經歷短暫的超極化並關閉 cGMP 通道。另一方面,在黑暗中,cGMP 濃度高,cGMP 通道處於開放狀態。當 cGMP 通道開啟時,這允許穩定的內向電流。與光感受器形成對比,嗅覺受體神經元在受到刺激時會開啟 cGMP 通道,而 cGMP 通道在靜止時會關閉。
cGMP 通道還可以透過利用神經系統中吸引和排斥分子的分子在引導神經生長錐中發揮作用。cGMP 通道聲稱的另一個功能是控制海膽精子的趨化性反應。Ca2+ 振盪是由 cGMP 訊號通路產生的,這些振盪引導精子。
最近對 cGMP 通道家族的研究發現,細菌和海膽精子研究中發現了新的成員,這些研究側重於新成員的功能和結構,表明結合單個分子足以開啟 cGMP 通道。與經典 cGMP 通道相比,新的 cGMP 通道之間存在幾個其他差異。
經典 cGMP 通道是異四聚體,具有 A 和 B 亞基。在哺乳動物中,已知哺乳動物中存在四種不同的 A 亞基和兩種不同的 B 亞基。
cGMP 通道有兩類:低配體敏感性和高配體敏感性。配體敏感性的差異由配體和 CNBD 之間不同的相互作用來組織。另一種確定配體選擇性的方法是 CNGA1 通道中的特定 Asp 殘基。側鏈具有負的 cGMP 選擇性並降低 cAMP 啟用效率。
在海膽精子和細菌中發現了新的 cGMP(環核苷酸門控離子通道),這些通道是不合作的,因為它們只需要一個配體分子結合才能開啟閘門。

對於眼睛中的光感受器,黑暗中存在高濃度的cGMP;光線在磷酸二酯酶處產生水解。對於嗅覺受體神經元,氣味分子啟動cAMP 的合成。

cGMP 多肽包含名為 S1-S6 的跨膜結構域。在 Ca、Na 和 K 通道中檢測電壓的 S4 具有在疏水性氨基酸之間分佈的一串帶電荷的 Lys 或 Arg 殘基。這與經典的 cGMP 通道不同,經典的 cGMP 通道不那麼依賴於電壓。穀氨酸是 cGMP 的關鍵成分:在含有孔隙的髮夾轉折部分,Glu 作為殘基攜帶;在四聚體中,一個 Glu 環提供了一個區域用於組織和移動 Ca+2 離子。
在 C 末端,環核苷酸結合結構域或 CNBD 透過大約 80 個氨基酸連線到 S6,這些氨基酸將配體的結合傳遞到通道的閘門。據認為,這種連線支援四聚化。
在 cGMP 的 A 和 B 部分,鈣調蛋白結合 (CaM) 與 Ca+2 決定了通道的活性。在嗅覺神經元中發現了四種這樣的 CaM 結合,但由於它們的 N 和 C 末端結合,只有 B 和 A4 的那些似乎很重要。已發現 CaM 和 Ca+2 之間的結合降低了對配體的敏感性,從而為平穩過渡到靜息狀態提供了更平滑的過渡。
來自細菌 Mesorhizobium loti 的 mlCNG 通道與經典 cGMP 通道相似,因為它建立了四聚體,並由六個跨膜片段組成,具有 C 末端 CNBD。它與經典 cGMP 通道的不同之處在於它包含了 K 通道的 GYGD 序列(Gly-Tyr-Gly-Asp)。此外,C-連線不是大約 80 個氨基酸,而是大約 20 個氨基酸,這導致它不支援四聚化。
CNGK 結構是 cGMP 通道,其孔隙區域具有 K 通道的序列。CNGK 具有一個大型多肽,該多肽包含四個具有相似序列或“重複”的區域。
科學家正在嘗試瞭解如何同時開啟所有四個閘門。他們使用雙電子-電子共振 (DEER) 來給出結構並指出殘基和構象運動在哪裡。
cGMP 通道幫助我們理解配體結合和閘門之間的關係。[2]
鉀通道基本上存在於大多數生物體中。鉀通道一定很古老,因為許多通道都起源於它們。通常,鉀離子有兩種型別,六跨膜螺旋電壓門控型和二跨膜螺旋內向整流型。通常,鉀通道具有 TMxTVGYG 的氨基酸序列。此外,六跨膜螺旋電壓門控型通常具有獨特的模式,即賴氨酸和精氨酸在序列中每三個或四個位置出現一次。科學家曾在一種稱為 KcsA 的細菌蛋白中研究了鉀,發現其結構與真核生物非常相似。因此,他們使用 KcsA 作為模型來研究 K+ 通道。
鉀通道以孔隙的形式位於質膜中,但不是隨機排列的。它起著重要的作用,因為它在體內的許多不同過程中發揮作用,例如激素分泌、調節血管系統等。鉀通道在植物中也很重要,因為保衛細胞使用 K+ 通道來控制滲透壓流動。鉀通道有兩個組成部分:過濾器和閘門。過濾器負責選擇離子,在本例中為鉀,而閘門根據外部環境(例如電壓的影響或訊號分子)開啟和關閉。過濾器的結構類似於血紅蛋白的結構,因為它是一個四聚體,具有四個圍繞孔隙的重複亞基。此外,這種結構被認為是不對稱的。此外,亞基是親水的。鉀離子透過通道的流動非常快。雖然名稱是鉀通道,但它也允許鈉離子透過。然而,鉀與鈉的比率為 10,000 比 1。鈉離子想要穿過通道的另一個原因是這些離子彼此競爭。
由於鉀通道與神經訊號傳導有關,如果通道不能正常工作,這會導致嚴重的損害。使鉀通道僅對 K+ 離子具有滲透性的原因是通道內氧的模擬。鉀已知在其周圍有水。在通道內壁上形成氧有助於鉀離子透過通道的流動。儘管人們對鉀通道瞭解很多,但 K+ 通道在原核細胞中的功能仍然是一個謎。
M2 質子通道位於甲型流感病毒的包膜中。M2 質子通道的結構是由二硫鍵連線的同四聚體。與鉀離子通道相似,它也是一個四聚體,由四個相似的亞基組成。在這種情況下,亞基就是 M2 本身。此外,亞基呈螺旋狀,並透過二硫鍵相互連線。當 pH 值較低時,M2 質子通道的功能最佳。M2 蛋白由三個部分組成:面向細胞外的 24 個氨基酸的 N 端,嵌入膜中的 22 個疏水性氨基酸,以及面向細胞質的 52 個氨基酸的 C 端。[3]
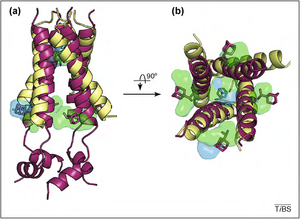
這 22 個氨基酸鍊形成一個跨膜 α 螺旋。由於氨基酸 Val27 靠近 N 端,因此 M2 通道對質子的選擇性非常高。因此,透過通道的質子只能以水分子形式透過,而像水合鈉這樣的分子很難透過。
質子通道的啟用發生在低 pH 環境下。M2 通道的主要功能是允許來自內體的氫離子進入病毒體並降低病毒內部的 pH 值。這會導致圍繞病毒基因組的基質蛋白解離,這對於將病毒內容物暴露於宿主細胞的細胞質中至關重要。[4] 兩種設計用於阻止 M2 通道功能的藥物是金剛烷胺和金剛乙胺。這兩種藥物可以阻止病毒攻擊宿主細胞。然而,由於 M2 容易受到突變的影響,因此使用這些藥物變得無濟於事。例如,如果膜中一個氨基酸發生改變,藥物將無法再阻斷病毒。已發現兩種 M2 結構:一種是突變的,位於膜中,第二種結構與第一種結構相似,但更長,並且具有 C 端成分。由於病毒對突變的敏感性,跨膜 α 螺旋上的替換導致病毒對抑制劑產生免疫。特別是 Ser31Asn 替換使蛋白高度抵抗金剛烷胺抑制。這種情況在 2009 年的“豬流感”大流行期間最為明顯,當時該季節檢測到的所有樣本都對金剛烷胺及其衍生物金剛乙胺產生了抗性。[5]
歷史
[edit | edit source]從 1950 年代初開始,科學家們開始瞭解離子通道的結構和功能,當時英國生物物理學家艾倫·霍奇金和安德魯·赫胥黎在 1951 年關於動作電位的研究中分析了離子通道電流的特性,這項研究為他們贏得了諾貝爾獎。離子通道的存在是由伯納德·卡茨和裡卡多·米萊迪在 1971 年間接證實的,後來由埃爾溫·內爾和伯特·薩克曼使用膜片鉗技術直接證明。2003 年,諾貝爾化學獎授予羅德里克·麥金農,表彰他對離子通道結構的X 射線晶體學研究,以及皮特·阿格雷對水通道蛋白的類似研究。
生物學意義
[edit | edit source]離子通道是神經系統的突出特徵,它允許突觸之間進行傳導。此外,離子通道促進細胞的快速變化,因此作為新型藥物的靶標非常有用。然而,離子通道對神經細胞功能的重要性導致動物和植物分泌的毒素的進化,這些毒素靶向中樞神經系統並導致癱瘓。一些例子包括河豚魚用於防禦的河豚毒素和阻斷鈉通道的奴佛卡因。其他例子包括由黑曼巴蛇產生的樹突毒素,它阻斷鉀離子通道。此外,編碼離子通道蛋白的 DNA 中的基因突變會導致相同型別的反應。
註釋
[edit | edit source]- ↑ http://www.ncbi.nlm.nih.gov/pubmed/20729090
- ↑ http://www.ncbi.nlm.nih.gov/pubmed/20729090
- ↑ Stouffer AL, Acharya R, Salom D, Levine AS, Di Costanzo L, Soto CS, Tereshko V, Nanda V, Stayrook S, DeGrado WF (2008). "Structural basis for the function and inhibition of an influenza virus proton channel" (PDF). Nature. 451 (7178): 596–9. doi:10.1038/nature06528. PMID 18235504.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Helenius, A. (1992) Unpacking the incoming influenza-virus. Cell 69,577–578
- ↑ Crosby, Niall J; Deane, Katherine; Clarke, Carl E (2003). Clarke, Carl E (ed.). "Amantadine in Parkinson's disease". Cochrane Database of Systematic Reviews. doi:10.1002/14651858.CD003468.
