結構生物化學/蛋白質/X射線晶體學
X射線晶體學
X射線晶體學可以揭示數千種蛋白質的詳細三維結構。 X射線晶體學分析中的三個組成部分是蛋白質晶體、X射線源和探測器。
X射線晶體學用於**透過研究分子生長固體晶體來研究分子結構。**晶體學家將高能X射線照射到包含數萬億個相同分子的微小晶體上。晶體將X射線散射到電子探測器上。電子探測器與在數碼相機中捕獲影像的型別相同。在每次持續幾秒到幾小時的X射線照射後,研究人員透過將所需的方位輸入控制X射線裝置的計算機來精確旋轉晶體。這使科學家能夠在三維空間中捕獲晶體散射或衍射X射線的方式。每條衍射射線的強度被輸入到計算機中,計算機使用數學方程來計算結晶分子中每個原子的位置。結果是分子的三維數字影像。
晶體學家用埃測量原子之間的距離。測量埃距離的完美“尺子”是X射線。晶體學家使用的X射線長約0.5到1.5埃,正好適合測量分子中原子之間的距離。這就是為什麼使用X射線。
蛋白質X射線晶體學是一種用於透過其結晶形式的X射線衍射獲得特定蛋白質的三維結構的技術。這種三維結構對於確定蛋白質的功能至關重要。製作晶體會在其中形成晶格,這種技術將數百萬個蛋白質分子排列在一起,使資料收集更加敏感。就像拿一堆紙,用尺子測量寬度,然後用頁數除以該長度來確定一張紙的寬度。透過這種平均技術,噪聲水平降低,信噪比提高。[2]蛋白質的活性位點和結合位點的特異性完全取決於蛋白質的精確構象。X射線晶體學可以揭示蛋白質分子中大多數原子的精確三維位置,因為X射線和共價鍵具有相似的波長,因此目前提供最佳的蛋白質結構視覺化。正是羅莎琳德·富蘭克林的X射線晶體學,使J.D.沃森和F.H.C.克里克能夠弄清楚DNA的雙螺旋結構。
我們使用此程式來掌握細胞機制以及酶和其他大分子3-D結構的知識。至關重要的是,我們能夠更好地理解細胞中發生的每個化學反應都需要特定酶才能發生。用於分析蛋白質結構的兩種常見技術是核磁共振 (NMR)和 X射線晶體學。X射線晶體學可用於分析任何不同化合物,最高可達 106 (g/mol) 的分子量;而NMR則限於生物聚合物(由生物體產生的聚合物,如澱粉、肽、糖),分子量不超過 30,000 (g/mol)。它還可以測量非常小的化合物,因為測量分子中原子之間距離的適當尺寸為 0.5 到 1.5 埃。X射線用作輻射形式,因為它們的波長與共價鍵的順序相同(約 1 Å 或 1 * 10−10m),這對於獲得揭示分子結構資訊的衍射圖樣是必需的。如果輻射的波長遠大於或遠小於共價鍵的鍵長,則光不會衍射,也不會獲得關於結構的新知識。
完成 X射線晶體學分析所需的三個組成部分是**蛋白質晶體**、**X射線源**和**探測器**。
該過程從結晶感興趣的蛋白質開始。蛋白質的結晶會導致所有蛋白質原子相對於彼此以固定的方式定向,同時仍保持其生物活性構象——這是 X射線衍射的必要條件。必須從溶液中沉澱或提取蛋白質。這裡的經驗法則是獲得儘可能純的蛋白質來生長大量晶體(這使得晶體具有帶電特性,並且表面帶電分佈有利於更好的散射結果)。為了實現蛋白質結晶,需要採取 4 個關鍵步驟,它們是
- 純化蛋白質。確定蛋白質的純度,如果不純(通常 > 99%),則必須進行進一步的純化。
- 必須沉澱蛋白質。通常透過將蛋白質溶解在適當的溶劑(水緩衝溶液,含 2-甲基-2,4-戊二醇等有機鹽)中來實現。如果蛋白質在水緩衝液或水有機緩衝液中不溶,則必須新增去垢劑(如十二烷基硫酸鈉)。
- 必須使溶液達到過飽和(使蛋白質從其餘溶劑中凝結,形成凝結核)。這透過向濃縮的蛋白質溶液中新增鹽來實現,降低其溶解度,使蛋白質形成高度有序的晶體(這個過程被稱為鹽析)。其他方法包括分批結晶、液-液結晶、蒸氣擴散和透析。
- 讓實際的晶體生長。由於形成了核晶體,這將導致獲得實際的晶體生長。
關於重結晶技術的說明,以獲得更純的蛋白質
重結晶是一種非常重要的技術,用於純化物質。瞭解固體在特定溶劑中的溶解度是重結晶的關鍵。這種技術的應用在製藥學和其他許多領域都有體現。例如,晶體學家使用核磁共振和X射線衍射方法來深入瞭解不同的化合物。X射線衍射需要形成純淨的晶體才能獲得準確的結果。晶體學家可以透過X射線衍射深入瞭解蛋白質結構,但為了能夠使用X射線檢查它們的晶體,他們必須首先花費時間形成純的蛋白質晶體。形成蛋白質晶體非常困難,甚至可能需要數年時間和極其特定的條件。溫度、pH值和濃度必須非常具體,才能形成具有純淨結構的大型晶體。在這個過程中,重結晶對於去除晶格中的雜質至關重要。如今,科學家使用晶體學和重結晶技術來理解蛋白質結構,並幫助理解蛋白質一級結構中單個異常如何導致疾病。總而言之,純化技術對於使用X射線衍射來理解結構至關重要。在本實驗中,我們探討了微觀重結晶和宏觀重結晶之間的差異。重結晶中使用的技術包括找到一個合適的溶劑、重力過濾、緩慢冷卻和真空過濾。成功的重結晶的關鍵在於合適的溶劑。我們需要一種在低溫下不會溶解樣品但在高溫下會溶解樣品的溶劑。這使得溶質在溶液在溫熱溫度下溶解後沉澱出來。由於溶質只溶於溫熱的溶質中,因此在冷卻後會形成沉澱。重力過濾用於去除重結晶前溶液中殘留的不可溶性雜質,它也用於過濾掉用於去除顏色雜質的活性炭。重力過濾是有效的,但我們必須避免在這個過程中結晶,以避免純淨晶體在濾紙中損失。緩慢冷卻對於確保晶體的純度和大小也至關重要。當溶液緩慢冷卻時,溶解的雜質有時間與溶劑相互作用,而不是被困在晶格中。在快速冷卻過程中,雜質可能會被困在晶格中,因為結晶發生得太快,雜質沒有時間返回到溶劑中。在將晶體放入冰浴中以確保最大程度的重結晶後,使用真空過濾將溶液過濾,以從包含雜質的溶液中提取純淨的晶體。在真空過濾後,收集並稱重純淨的晶體。微觀重結晶與宏觀重結晶的不同之處在於用於過濾純淨晶體的儀器和技術。微觀重結晶包括使用克雷格管和離心分離,而不是真空過濾。它用於少於300毫克固體的重結晶。
下一步,產生X射線並將其照射到結晶的蛋白質上。X射線可以透過四種不同的方法產生:
- 用高能電子束轟擊金屬源
- 將物質暴露在初級X射線束中,以產生次級X射線熒光束
- 從產生X射線的放射性衰變過程中(伽馬射線與X射線沒有區別)
- 從同步加速器(具有恆定頻率電場的迴旋加速器)輻射源
第一種和最後一種方法利用了軔致輻射現象,即加速電荷會釋放輻射。
然後,將X射線照射到蛋白質晶體上,導致一些X射線穿過晶體,而其餘X射線則被散射到不同的方向。X射線的散射也被稱為“X射線衍射”。這種散射是由輻射的電場和磁場與晶體原子中電子的相互作用造成的。
這些圖案是衍射X射線之間干涉的結果,受布拉格定律控制:,其中是兩個電子密度區域之間的距離,是衍射角,是衍射X射線的波長,是一個整數。如果反射角滿足以下條件
,
衍射X射線將發生相長干涉。否則,將發生相消干涉。
以下是一個相長干涉的例子
以下是一個相消干涉的例子
相長干涉表示衍射X射線處於相位或彼此對齊,而相消干涉表示X射線不完全處於彼此的相位。結果是,測量的X射線強度隨著角度和探測器與晶體之間距離的變化而增加和減少。
被散射到各個方向的X射線隨後被X射線膠片捕獲,膠片顯示乳劑的變黑程度與照射到膠片的散射X射線的強度成正比,或者被固態探測器捕獲,例如數碼相機中的探測器。晶體被旋轉,以便X射線能夠從各個側面和角度照射到蛋白質。膠片上的圖案揭示了有關蛋白質結構的許多資訊。這種技術背後的三個基本物理原理是
- 原子散射X射線。衍射X射線的振幅與原子中的電子數量成正比。
- 散射波重新組合。如果光束處於相位,它們將在膠片上相互加強,如果它們處於相位,它們將相互抵消。每個原子都會對散射光束做出貢獻。
- 三維原子排列決定了光束如何重新組合。
因此,點的強度及其位置是分析的基本實驗資料。
最後一步是根據膠片上衍射圖案的測量強度建立電子密度圖。可以將傅立葉變換應用於膠片上的強度,以重建晶體的電子密度分佈。在這種情況下,傅立葉變換採用電子密度的空間排列,並以X射線膠片上衍射圖案的形式給出空間頻率(原子之間的間距)。傅立葉變換的一個日常例子是音樂播放器上的音樂均衡器。均衡器不是顯示實際的音樂波形,而是顯示各種頻率帶的強度,因為音樂波形難以視覺化。透過傅立葉變換,電子密度分佈被顯示為一系列堆疊在一起的平行形狀和線(等高線),就像地形圖一樣。該對映提供了透過X射線晶體學觀察到的電子密度的三維表示。在解釋電子密度圖時,需要考慮解析度。5Å - 10Å 的解析度可以揭示多肽鏈的結構,3Å - 4Å 的解析度可以揭示原子組,1Å - 1.5Å 的解析度可以揭示單個原子。解析度受晶體結構的限制,對於蛋白質而言約為 2Å。
蛋白質分子非常大,因此它們的晶體比小分子晶體散射X射線束少得多。由於較大的分子具有較少的晶體,因此衍射散射和發射的強度非常弱。蛋白質含有碳、氮和氧,因此是較輕的元素(即它們具有較少的電子/原子);這很重要,因為電子是造成衍射和強度的主要原因,因此它們的X射線散射強度比重元素弱。瞭解這一點後,蛋白質晶體學家使用高強度X射線源(如旋轉陽極管或強大的同步加速器X射線源)來分析蛋白質晶體。
- 原子中電子的數量與波的振幅成正比。例如,比較碳原子和氫原子,你會發現碳原子的散射強度是氫原子的六倍。
- 如果波在薄膜處同相,則波會相互疊加;如果波異相,則波會在薄膜處相互抵消。
- 觀察散射波如何重新組合時,唯一重要的是原子排列。
X射線的能量
- 其中 *f* 是頻率,*λ* 是波長。能量的 SI 單位是焦耳 (J)。
由於 X 射線的波長較短,因此其能量高於可見光。
相位問題
[edit | edit source]X 射線與晶體中電子的相互作用會產生衍射圖案,從數學上來說,它是電子密度分佈的傅立葉變換。然而,用於測量 X 射線的探測器只能測量衍射 X 射線的振幅;相移是使用傅立葉變換並找到電子密度分佈所必需的,但使用此方法無法直接測量。這在物理學界被稱為“相位問題”。簡單來說,無法從測量的 X 射線振幅中找到相位。為了獲得電子密度圖,必須進行其他推斷並進行額外的實驗。許多時候,有關化合物物理和化學性質的現有資料可以在密度圖較差時提供幫助。另一種稱為帕特森合成的 方法對於找出初始相位估計非常有用,並且對於在相位未知時確定蛋白質結構的初始階段非常有用。透過使用帕特森合成找到一個原子(通常是一個重金屬原子)可以簡化問題,然後使用該原子的位置來估計初始相位並計算初始電子密度圖,這可以進一步幫助對其他原子的位置進行建模並進一步改進相位估計。另一種方法稱為分子置換;它定位了蛋白質結構在細胞中的位置。除了分子置換方法外,相位問題也可以透過同晶置換方法、多波長異常衍射方法、單波長異常衍射方法和直接方法來解決。
分子置換
[edit | edit source]如果有一個可以計算相位的原子模型,則可以解決相位問題。如果已知相關蛋白質結構,則可以獲得模型。但是,為了構建此原子模型,需要確定模型在新的晶胞中的方向和位置。這時,分子置換 (MR) 技術就派上用場了。
分子置換,也稱為 MR,是一種解決 X 射線晶體學中相位問題的 方法。MR 定位了蛋白質結構與其晶胞的方向和位置,其蛋白質結構與需要確定的未知蛋白質結構同源。獲得的相位可以幫助生成電子密度圖,並幫助生成蛋白質結構模型位置的計算強度,以與 X 射線晶體學實驗中觀察到的結構相對應。
MR 方法對於解決大分子晶體結構也同樣有效。由於不需要製備重原子衍生物和收集資料,因此這種方法需要更少的時間和精力來確定結構。該方法很簡單,模型構建也簡化了,因為它不需要鏈追蹤。
此方法包括兩個步驟
- a. 旋轉搜尋以將同源模型定位到晶胞或目標中
- b. 平移目標,其中新的定向模型定位在晶胞中
帕特森基 (分子置換)
[edit | edit source]帕特森圖是原子間向量圖,包含晶胞中每個相關原子的峰值。如果帕特森圖是根據從電子密度圖得出的資料生成的,則只有當模型正確定向並放置在正確位置時,兩個帕特森圖才應該緊密相關。這將使我們能夠推斷有關未知蛋白質結構與其細胞位置的資訊。然而,分子置換存在一個問題,它有六個維度,三個引數用於指定方向和位置。使用帕特森圖,可以將其劃分為引數子集以分別檢視每個部分。
旋轉函式
[edit | edit source]旋轉函式具有分子內向量,這些向量僅取決於分子的方向,而不取決於其位置,因為即使當分子在晶胞中平移時,所有原子都會移動相同的距離,但原子之間的向量是相同的。比較未知蛋白質結構的帕特森圖與同源已知蛋白質結構在不同方向上的帕特森圖

經典旋轉函式
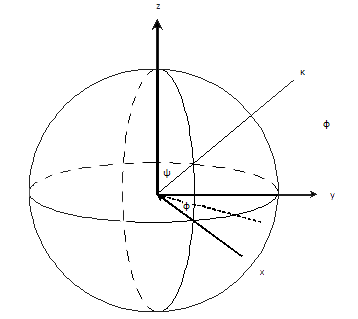
[edit | edit source]為了找到方向,確定旋轉軸和繞該軸的旋轉角。定義軸將需要兩個引數(從球體中心到球體表面一點的向量)。旋轉軸最初與 z 軸平行,並繞 y 軸旋轉角度 ᶱ,然後物體繞 z 軸旋轉角度 ᶲ,最後繞旋轉軸旋轉角度 ᵠ。這些指定了單位球表面上的一個點。
快速旋轉函式
[edit | edit source]可以透過比較兩個帕特森圖或這些帕特森圖中的峰值來計算旋轉函式。如果帕特森圖用球諧函式表示,則可以透過傅立葉變換更快地計算旋轉函式。
直接旋轉函式
[edit | edit source]在直接旋轉函式中,蛋白質結構可以放置在未知結構的晶胞中,並且將定向分子的帕特森圖與整個未知結構帕特森圖進行比較。
平移函式
[edit | edit source]一旦已知結構的方向,就可以對其模型(電子密度圖)進行定向以計算結構因子,其中相關函式用於確定向量以將模型平移到非對稱單元內同源模型的頂部。
使用正確定向和平移的蛋白質結構相位模型,可以從匯出的相位中準確地推匯出電子密度圖。電子密度圖可用於構建和最佳化未知結構的模型。
多波長異常衍射
[edit | edit source]X射線是在稱為同步加速器的巨大機器中產生的。同步加速器將電子加速到接近光速,並在一個大型的空心金屬多邊形環中穿行。在每個拐角處,磁鐵彎曲電子流,導致以電磁輻射的形式發射能量。由於電子以光速運動,因此它們會發射高能X射線。
使用同步加速器的優點是,研究人員不必培養每種結晶分子的多個版本,而是隻培養一種含有硒的晶體型別。然後,他們有能力調整波長以匹配硒的化學性質。這種技術被稱為多波長反常衍射。然後用不同長度的波長多次轟擊晶體,最終出現衍射圖案,使研究人員能夠確定硒原子的位置。該位置可以用作參考或標記來確定其餘結構。這種優勢使研究人員能夠更快地收集資料。
該方法比較了原始蛋白質晶體與相同型別的晶體(至少添加了一個原子核數較高的原子)之間的 X 射線衍射圖案。該方法用於確定小分子的結構,並最終由 Max Ferdinand Perutz(1914-2002)確定了血紅蛋白的結構。完美的同晶是指原始晶體及其衍生物具有完全相同的蛋白質構象,分子的位置和方向以及晶胞引數。在完美的同晶中,晶體及其衍生物唯一的區別是由於在衍生物上添加了重原子而導致的強度差異。這些差異可以透過手動或透過自動帕特森搜尋程式(例如 SIR 2002、SHELXD、nB 和 ACORN)來識別,此類資訊對於確定蛋白質相位角非常重要。但是,由於晶胞尺寸的變化,完美的同晶幾乎不會發生。對於含有重原子的蛋白質,其晶胞尺寸的容許變化為 dmin/4,其中 dmin 是解析度極限。其他因素(例如旋轉)也會導致非同晶。
- 製備幾種蛋白質的衍生物,使其具有晶體結構。然後測量晶胞尺寸以檢查同晶性。
- 收集原始蛋白質及其衍生物的 X 射線強度資料。
- 應用帕特森函式來確定重原子的座標。
- 最佳化重原子引數並計算蛋白質的相位角。
- 計算蛋白質的電子密度。
衍生物透過兩種不同的方法制成。首選的方法是在與母液成分相同的溶液中浸泡蛋白質晶體,但沉澱劑濃度略有增加。另一種方法是共結晶,但它不常用,因為晶體不會生長或異形生長。浸泡過程取決於晶體孔隙的寬度。孔隙應足夠寬,以便試劑能夠擴散到晶體中併到達晶體中所有蛋白質分子表面的反應位點。
多波長反常衍射(簡稱 MAD)是一種在 X 射線晶體學中使用的方法,它允許我們確定生物大分子(如蛋白質和 DNA)的結構,以解決相位問題。結構要求包括會導致 X 射線顯著散射的原子;值得注意的是來自金屬蛋白的硫或金屬離子。由於硒可以取代天然硫,因此它更常用。使用這種技術極大地簡化了晶體學家使用多同晶置換 (MIR) 方法,因為重化合物的製備是不必要的。
這種方法用於解決相位問題,當沒有關於散射衍射的資訊可用,除了振幅。此外,當重金屬原子已經繫結在蛋白質內部,或者當蛋白質晶體不是同晶的,不適合 MIR 方法時,它被使用。該方法主要用於重金屬溶液,這些金屬酶通常來自第一過渡系列及其鄰近元素。重要的是要有一個強大的磁場源來進行此實驗,應考慮地下等環境。該方法還需要一種稱為同步加速器的粒子加速器。
與多波長反常衍射 (MAD) 相比,單波長反常衍射 (SAD) 使用來自單個波長的單個數據集。MAD 和 SAD 之間的主要有利區別在於,晶體在 SAD 中花費在 X 射線束中的時間更少,這減少了對分子的潛在輻射損傷。此外,由於 SAD 只使用一個波長,因此比 MAD 更省時。
從單波長反常衍射資料推匯出的電子密度圖確實需要進行修改才能解決相位歧義。一種常見的修改技術是溶劑平滑,當 SAD 與溶劑平滑相結合時,由此產生的電子密度圖與從完整 MAD 相位推匯出的電子密度圖具有可比的質量。溶劑平滑涉及調整蛋白質分子之間被溶劑佔據的間隙區域的電子密度。假設溶劑區域與蛋白質相比相對無序且無特徵。平滑溶劑區域的電子密度將增強蛋白質的電子密度到可解釋的程度。這種方法被稱為 ISAS,即迭代單波長反常散射。
直接法可以幫助使用它獲得的資料來恢復相位。直接法使用三重關係來估計初始相位和擴充套件相位。三重關係是反射強度和相位與另外兩個強度和相位之間的關係。使用此方法時,蛋白質結構的大小很重要,因為相位機率分佈與原子數的平方根成反比。直接法是解決相位問題的最有用技術。
Paul Peter Ewald 和 Max von Laue 在 1912 年提出了使用晶體作為 X 射線的衍射光柵的想法。von Laue 提出,與可見光的較長波長相比,X 射線可能具有接近晶體晶胞間距的波長。他與 Walter Friedrich 和 Paul Knipping 合作,將硫酸銅晶體的 X 射線衍射記錄到照相板上。von Laue 開發了散射角與晶胞間距大小及其在晶體中的方向之間的關係,並於 1914 年獲得諾貝爾物理學獎。作為 von Laue 研究的結果,William Lawrence Bragg 開發了一項定律來連線晶體觀察到的散射和從晶體中均勻間隔的平面上的反射。這可以用來推斷原子結構,而布拉格定律對確定分子結構的重要性立即得到了認可。1914 年,第一個被解決的結構是食鹽。它的電子分佈證明了不僅共價化合物而且離子化合物都可以形成晶體。
1914 年,使用 X 射線解決了金剛石的結構,並表明碳到碳的單鍵長度為 1.52 埃。
X 射線晶體學首次用於在 1950 年代後期確定蛋白質結構。
John Kendrew 和 Max Perutz 都在劍橋大學工作,他們在 1945 年使用 X 射線晶體學發現了血紅蛋白和肌紅蛋白(肌肉中的氧氣載體)的結構。他們於 1962 年獲得諾貝爾化學獎。
透過 X 射線晶體學確定的第一個酶的三維晶體結構是雞蛋清溶菌酶。這尤其重要,因為它提供了過渡態理論的視覺證據,因為它是過渡態幾何形狀互補於催化位點的物理證明。在第一個晶體結構之後,許多不同酶的 X 射線結構報告激增。[3]
藥物發現和醫學的許多進步很大程度上歸功於 X 射線晶體學,透過識別當今流行的許多疾病中的藥物靶點。例如,在 80 年代後期,科學家在使用 X 射線晶體學產生 HIV 蛋白酶的結構方面取得了突破,HIV 蛋白酶是一種對逆轉錄病毒生命週期至關重要的酶。該酶切割病毒蛋白鏈,這些蛋白鏈是未成熟病毒細胞的主要成分,將其切割成單獨的成熟蛋白質,這些蛋白質可以繼續形成更多成熟的和具有傳染性的病毒顆粒。透過仔細觀察其結構,特別是其對稱性,研究人員開始製造與酶的活性位點相互作用的化合物,該活性位點位於其對稱半部的中間,以關閉酶並阻止其正常運作。令人驚訝的是,到 90 年代中期,三種 HIV 蛋白酶抑制劑藥物已上市,大大降低了艾滋病毒的死亡率。[4]
X射線晶體學不僅是藥物發現的有力工具,也已被證實對改進藥物療效具有重要意義。例如,目前帕金森病的治療方法是抑制單胺氧化酶B [MAO B],這種酶有助於神經遞質的迴圈利用,透過去除一些有時至關重要的非活性分子成分來實現。雖然這種抑制劑有效,但會引起一些不良副作用,例如心率、血壓、呼吸等的改變。然而,透過確定MAO B的三維結構,以及觀察一些抑制劑如何與酶結合,埃默裡大學的Dale Edmondson及其同事開始考慮開發新的藥物,這些藥物能更特異性地與酶結合,以最終減少副作用。[5]
此外,X射線晶體學有助於解釋藥物在體內的作用機制,它們如何相互作用,是什麼讓它們起作用等等。一個很好的例子就是廣泛應用的阿司匹林。阿司匹林能透過阻斷人體代謝和免疫系統中已知的環氧化酶(COX)來阻斷前列腺素的產生,而前列腺素是一種在代謝中起著多種重要作用的信使分子。科學家們能夠透過X射線晶體學研究COX酶並確定其結構,並由此清楚地瞭解酶結構的精確細節如何對其整體分子功能做出貢獻。透過確定COX酶的三維結構,我們可以瞭解像阿司匹林這樣的藥物如何與之相互作用並阻斷其活性。[6]
由美國宇航局進行的MIR實驗表明,一些蛋白質在微重力環境下會產生更高質量的晶體。DCAM,即環境擴散控制蛋白質晶體生長法,是這些實驗中使用的方法。DCAM採用液-液擴散法生長蛋白質晶體。這些蛋白質透過太空梭軌道器被送往和平號空間站進行結晶。蛋白質晶體後來被帶回地面進行X射線衍射分析。結果令人鼓舞。某些蛋白質所產生的最大晶體就是透過這些實驗得到的。這些蛋白質包括溶菌酶、白蛋白和組蛋白八聚體。細菌視紫紅質,一種與膜相關的蛋白質,產生了尺寸和質量都有所改善的晶體。此外,在微重力環境中進行的DCAM證明了成功地提供了異常大的蛋白質晶體,這些晶體可以用於中子衍射分析結構,而中子衍射技術無法用於在地球上生長的較小晶體。這些令人鼓舞的結果可以為地球上的人們帶來許多益處。蛋白質晶體是製造治療藥物所必需的。科學家們可以透過在太空中培育蛋白質晶體來開發治療疾病的新藥,而這些晶體在地球上由於受重力的限制,無法生長到足夠大的尺寸。
X射線晶體學的一些優勢是,即使原子結構處於溶液中,該技術本身也能獲得原子解析度結構。這是因為晶體形式的結構與溶液中的結構相同。[需要引用]另一個優勢是,原子結構包含大量關於結晶純蛋白質的資料。從蛋白質結構中獲得的資訊可以提供比在細胞環境中尋找其特定位置更多的資訊。
利用X射線晶體學來確定蛋白質結構,已經在結構生物化學領域取得了巨大而重大的突破。
雖然研究人員尚未找到治癒艾滋病的方法,但結構生物學極大地提高了他們對艾滋病毒的瞭解,並在開發治療這種致命疾病的藥物方面發揮了關鍵作用。艾滋病毒被迅速認定為逆轉錄病毒,這種病毒的遺傳物質不是DNA,而是RNA。在艾滋病毒出現很久之前,世界各地的實驗室研究人員就一直在研究逆轉錄病毒,其中一些逆轉錄病毒會導致動物患癌。這些科學家追蹤了逆轉錄病毒的生命週期,並確定了病毒用來感染細胞的關鍵蛋白質。當艾滋病毒被確認為逆轉錄病毒時,這些研究為艾滋病研究人員提供了一個立即的助力,使他們能夠將先前發現的病毒蛋白作為最初的藥物靶點。
科學家們還在1989年確定了艾滋病毒蛋白酶的X射線晶體結構,這種病毒酶在艾滋病毒的生命週期中至關重要。製藥科學家希望透過阻斷這種酶,能夠阻止病毒在體內傳播。科學家們終於看到了他們的目標酶。透過將結構資訊輸入計算機模型程式,他們可以旋轉酶模型,放大特定原子,分析其化學性質,甚至剝離或改變其部分結構。最重要的是,他們可以使用模型結構作為參考來確定可能阻斷酶的分子型別。這種基於結構的藥物設計策略有可能縮短傳統的藥物開發過程中試錯過程所花費的數年時間和數百萬美元。艾滋病毒蛋白酶的結構揭示了一個至關重要的發現,這種酶由兩個相等的半部分組成。對於大多數這種對稱分子來說,兩個半部分都有一個活性位點,該活性位點執行酶的功能,但艾滋病毒蛋白酶只有一個活性位點位於兩個半部分相遇的分子中心。製藥科學家可以利用這一特點,透過用一個小分子阻斷單個活性位點,理論上可以利用酶的結構形狀作為指導,關閉整個酶並阻止病毒在體內的傳播。
塞來昔布最初被設計用於治療骨關節炎和成人類風溼性關節炎,併成為第一個被批准用於治療一種罕見疾病FAP(家族性腺瘤性息肉病)的藥物,該病會導致結腸癌。一個幸運的發現使科學家能夠設計出保留非甾體抗炎藥的抗炎特性的藥物,而不會產生引起潰瘍的副作用。透過在分子水平上研究這些藥物,研究人員發現非甾體抗炎藥會阻斷兩種密切相關的酶(稱為環氧化酶)的作用:COX-1和COX-2。COX-2是在損傷或感染的情況下產生的,它會啟用引發炎症和免疫反應的分子。透過阻斷COX-2,非甾體抗炎藥可以減少由關節炎、頭痛和扭傷引起的炎症和疼痛。相反,COX-1會產生一種叫做前列腺素的分子,這種分子可以保護胃壁免受消化酸的侵蝕,因此當非甾體抗炎藥阻斷這一功能時,會導致潰瘍。
為了創造一種不會引起潰瘍的有效止痛藥,科學家們意識到他們需要開發出新的藥物,這些藥物可以關閉COX-2,但不會關閉COX-1。透過結構生物學,他們可以確切地看到為什麼塞來昔佈會堵塞COX-2,而不會堵塞COX-1。COX-2和COX-1的三維結構幾乎完全相同,除了COX-2活性位點中有一個氨基酸的改變,它會形成一個額外的結合口袋。正是這個額外的口袋可以與塞來昔布結合。除了向研究人員展示藥物與其靶標結合的原子細節外,COX酶的結構也將繼續為基礎研究人員提供這些分子在體內如何發揮作用的見解。
X射線晶體學的一些缺點是,樣品需要處於固態,樣品必須以足夠大的數量存在才能進行研究,而且樣品經常會被用於研究它的X射線輻射破壞。這意味著氣態或液態的任何物質都無法透過X射線晶體學進行分析。此外,稀有或難以合成的樣品可能難以研究,因為可能沒有足夠的樣品供輻射提供清晰的影像。第三,研究生物樣品可能會有問題,因為用於研究樣品的輻射很可能會損害或破壞活組織。
還需要考慮到,X射線晶體學對單個蛋白質結構的分析需要大量時間。每個步驟的大致時間估計如下:在完美執行和99%純化的情況下,克隆和純化蛋白質結構需要3-6個月。結晶過程可能需要1-12個月,這取決於蛋白質的物理特性,而這些特性完全取決於誘導晶體形成的有利焓值和晶體形成所處的溶劑。此外,對結晶蛋白質結構進行資料收集可能需要一個月的時間。最後,對溶液中的結構進行相位確定可能需要3個月的時間。綜上所述,該過程並不快,這意味著當佔用很長時間並使用各種實驗室裝置時,會產生財務問題。
- 要了解更多關於蛋白質X射線晶體學的資訊,請參見Drenth, Jan: 蛋白質X射線晶體學原理 第三版。
- ↑ 美國衛生與公眾服務部。生命的結構。2007年7月。<http://www.nigms.nih.gov>.
- ↑ Viadiu, Hector. "為什麼我們需要晶體?" UCSD講座。2011年11月。
- ↑ Kraut, Joseph. "酶是如何工作的?", 科學, 第242卷, 1988年10月28日, 第534頁
- ↑ 美國國立衛生研究院, 生命的結構, 2007年, 第37-38, 40, 44頁。
- ↑ 美國國立衛生研究院,“設計藥物”, 2006年, 第31頁。
- ↑ 美國國立衛生研究院,“設計藥物”, 2006年, 第25-27頁。
- ↑ 美國衛生與公眾服務部。生命的結構。2007年7月。<http://www.nigms.nih.gov>.
- ↑ 美國衛生與公眾服務部。生命的結構。2007年7月。<http://www.nigms.nih.gov>.
Berg, Jeremy M., John L. Tymoczko, 和 Lubert Stryer. 生物化學。第6版。紐約:W. H. Freeman and, 2006. 印刷版。









