結構生物化學/有機化學/有機官能團/醯胺

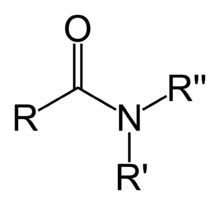
醯胺官能團由與氮原子相連的羰基組成。在簡單的醯胺中,兩個氫原子與氮原子相連(-CONH2),而在更復雜的醯胺中,氮原子與一個或兩個脂肪族或芳香族基團相連(-CONR)。
醯胺的命名與羧酸的命名非常相似。對於 IUPAC 命名法,首先命名羧酸,然後去掉“-oic acid”並新增“amide”。例如,丙酸會變成丙醯胺,乙酸會變成乙醯胺。名稱的第一部分取決於醯胺連線到的碳鏈。
與類似的胺不同,醯胺由於氮原子上的孤對電子發生離域,因此不顯示可測量的鹼性。在正常的胺或-NH2官能團中,氮原子上的孤對電子可以接受氫原子,從而起到鹼的作用。但是,在醯胺中,雙鍵碳原子和氧原子之間形成的π鍵包含幾乎平行於氮原子孤對電子的p軌道。這會導致電子對發生離域,並在羰基部分的整個分子中共享。離域降低了醯胺的鹼性,因為電子對不與單個原子相關聯,從而降低了其吸取質子的強度和集中度。離域也有助於穩定醯胺的整體結構,因此需要更多能量來破壞共享的電子結構。
甲醯胺在室溫下為液體,而其他醯胺則保持固體。相對於其尺寸,醯胺具有相對較高的熔點,這是因為-NH2基團中的部分正電性氫原子與另一個電負性氧原子之間存在氫鍵。每個簡單的醯胺都有兩個部分正電性的氫原子和氧原子上的兩對電子,從而可以形成多個可能的氫鍵位置。打破這些氫鍵需要大量的能量,從而提高了醯胺的熔點。
小分子醯胺可溶於水,因為它們可以與水分子形成氫鍵。大分子醯胺由於其長疏水性碳鏈而難以溶解。醯胺通常比胺和羧酸溶解度低,因為它們既可以提供又可以接受氫鍵。
羧酸可用於製備醯胺,方法是在酸中與固體碳酸銨反應形成銨鹽。加熱後,該鹽脫水生成醯胺和水。醯氯(酸氯)會與氨劇烈反應生成氯化銨和醯氯的醯胺。酸酐也會與氨反應生成醯胺,例如乙酸酐與氨反應生成乙醯胺和乙酸銨。
醯胺是由胺和羧酸之間的反應生成的。在這兩個分子之間,我們有兩個競爭性的親核試劑,即羧酸分子中醇基的氧原子和胺的氮原子。親核試劑是一種在反應中向親電試劑捐贈一對電子的化學物質,從而形成化學鍵。由於氮原子位於氧原子的左側,因此氮原子比醇原子具有更好的鹼性和親核性。胺與羧酸之間的反應基於加成和消除反應。雖然這是一個簡單易行的反應,但它不是生產醯胺的最有效和最有效的方法。這兩種物質之間的反應也包含競爭性酸鹼反應,從而生成鹽。因此,由於存在競爭性產物,這兩種物質之間的加成消除反應並不是分離醯胺的最有效方法。更好的方法是醯滷(活化的羧酸衍生物)與胺之間的反應。用鹵素取代羧酸中的羥基會產生一種稱為醯滷的反應性分子。由於鹵素是電負性最大的原子,因此其存在於分子中會將電子拉離羰基碳原子,從而產生一個親電位點。當存在親電位點時,胺的親核氮原子將很容易與醯滷反應形成醯胺。
步驟 1:親核氮原子進攻羰基的碳原子,將羰基雙鍵的電子推向氧原子。形成兩性離子(氧原子帶負電荷,氮原子帶正電荷)。
步驟 2:形成有利且更穩定的羰基,將鹵素踢出。
步驟 3:鹵素返回並從氮原子中去除一個氫原子,形成醯胺和鹵化氫,從而消除正電荷。
醯胺的水解可以在酸性和鹼性條件下進行。在酸性條件下,稀酸催化的醯胺與水反應生成羧酸和氯化銨。例如,在稀鹽酸中加熱乙醯胺會生成乙酸和氯化銨。如果在鹼性條件下(如氫氧化鈉溶液)加熱,乙醯胺會生成氨氣和乙酸鈉鹽。
醯胺可以透過與五氧化二磷反應脫水,例如在五氧化二磷存在下加熱乙醯胺會生成乙腈,並失去水。霍夫曼降解反應涉及醯胺與溴和氫氧化鈉的混合物反應,導致羰基的損失,例如乙醯胺降解生成甲胺。

聚醯胺通常是指由醯胺鍵連線在一起的聚合物。尼龍是由醯胺鏈連線的重複碳鏈組成,而凱夫拉爾是由苯鏈而不是碳鏈組成。尼龍是由己二酸和己二胺反應脫水形成的,而凱夫拉爾是由苯二甲酸和二氨基苯反應形成的。尼龍在商業上用於服裝、地毯、繩索和輪胎,而凱夫拉爾的高強度重量比使其適用於防彈背心和其他輕質耐用需求。
