結構生物化學/蛋白質/冷凍電子顯微鏡
冷凍電子顯微鏡專門用於解釋和視覺化未染色生物複合物,例如病毒、小型細胞器和大分子生物複合物,這些複合物大小在 200 kDa 或更大,儲存在玻璃態(即玻璃態或非晶態)冰中。基本目標是將其他電子顯微鏡技術與冷凍固定技術進行比較,以快速冷凍生物樣品,以避免破壞其水性環境。這避免了超微結構改變、元素重新分佈和物質洗脫。冷凍在玻璃態冰中的樣本顯示出與液態或天然狀態相似的結構。近似天然成像條件允許對細胞機器進行三維重建。利用最先進的計算機控制的自動化顯微鏡、影像重建軟體和視覺化工具,可以實現大型生物複合物的亞奈米級解析度結構。在冷凍電子顯微鏡中,電子束,即高能粒子流轟擊樣品。觀察到的影像是在樣品與該束相互作用的結果。形成高解析度影像的大多數電子出現在彈性散射中,其中僅改變了它們的軌跡,但它們的能量不受影響。但是,一小部分電子將它們的部分能量轉移到樣品。這種能量積累並可以破壞分子鍵,一段時間後破壞樣品。因此,為了進行高解析度成像,低劑量引數要求在實際拍攝影像之前不暴露要成像的區域。
冷凍電子顯微鏡可以透過各種樣品製備方法進行,兩種常用的方法使用生物材料的薄膜和玻璃態切片。薄膜法要求將生物材料放置在電子顯微鏡網格上,並在接近液氮溫度下快速冷凍。較大的樣本(玻璃態切片)可以透過不同的方法進行玻璃化,包括高壓冷凍。然後可以將這些樣品切成薄片並放置在電子顯微鏡網格上,類似於薄膜。這些樣品必須保持在液氮溫度下才能進行高真空處理,並暴露於電子束中。
冷凍電子顯微鏡的一個分支是冷凍電子斷層掃描(CET)。冷凍電子斷層掃描在低溫下進行,就像冷凍電子顯微鏡一樣;CET 從 2D 影像構建 3D 樣品。
冷凍電子顯微鏡用於各種領域。奈米粒子研究嚴重依賴電子顯微鏡來視覺化小粒子。進行藥物研究的製藥公司利用電子顯微鏡來幫助預測藥物和生物物質的行為。在藥物研究的情況下,3D 視覺化非常有用,並且在冷凍電子顯微鏡中,對樣品的損傷最小,可以獲得可用的影像。
- 允許檢查生物樣品的天然和水合結構特徵。樣品始終處於溶液中,並且從未與附著表面接觸。因此,觀察到的形狀是水合分子在溶液中的真實形狀,並且沒有因其自身附著和壓平在支撐膜上而發生扭曲。
- 在顯微鏡真空條件下提供良好的生物結構儲存。
- 沒有染色劑或化學固定劑會扭曲樣品。當染色時,樣品會以多種方式受到損壞,例如壓平和扭曲。
- 當樣品附著在碳網格上時,它可能以優先方向粘附。如果發生這種情況,那麼最終影像集中將缺少資訊(缺失錐體),並且計算模型在該方向上的解析度將不存在。
- 與類似的糖包埋或冷凍乾燥的樣品相比,在室溫下,輻射損傷降低了 2-5 倍。據認為,其背後的原因是減少了由鍵斷裂導致的片段的溫度依賴性重排或擴散。在固體冷凍狀態下,重排或擴散減少,並且蛋白質構象更可能在更高的照射水平下保持。
- 可以觀察到核酸、蛋白質和脂質之間的對比度得以區分。
- 使人們能夠控制化學環境,以便可以檢查分子的不同功能狀態。
- 信噪比非常低。生物大分子通常由碳、氫、氧和氮組成。這些分子的電子吸收非常低。因此,影像對比度也非常低,在處理僅幾幅影像時很難檢測到特徵。
- 難以從傾斜的樣品獲得影像。傾斜冷凍樣品的冰橫截面太厚,無法產生良好的影像。
- 成像傾斜冷凍樣品時,充電現象更加普遍。
- 生成樣品需要更多時間。但是,這通常不是一個大問題,尤其是在設計好工作方案並且易於獲得良好樣品之後。
- 如果無法輕鬆形成玻璃態冰,那麼形成的立方冰會非常容易吸收電子,並且冷凍樣品基本上毫無價值。
- 樣品必須保持在低於 135 攝氏度。
以下是製備冷凍水合生物樣品的一些通用程式:1)開發生物樣品的薄層。 2)快速冷卻樣品至玻璃態。 3)將樣品轉移到電子顯微鏡中,不要重新加熱到高於玻璃化溫度。 4)在低於玻璃化溫度下觀察樣品,電子劑量足夠低以保護樣品的結構。

斷層掃描利用能量波對固體物體的效果和差異來產生內部結構的三維影像。冷凍電子斷層掃描是冷凍電子顯微鏡的一個分支,其中在低溫下,冷凍樣品的二維投影被記錄並用於透過計算機反投影來重建三維結構。這是使用透射電子顯微鏡來拍攝樣品的連續影像,同時圍繞軸線傾斜樣品來完成的。 “投影定理”指出可以從沿不同方向的投影中檢索 3D 物體。因此,要獲得物體的 3D 描述,必須沿不同方向投影它;這是透過逐步傾斜樣品來實現的。由於透射電子顯微鏡 (TEM) 的侷限性,樣品只能傾斜到 +- 60-70 度,而不是 90 度,這對於檢索有關樣品的全部 3D 資訊是必要的。
冷凍電鏡斷層掃描 (Cryo-ET) 是一種非常精確的方法,可以確定樣品的 3D 結構,因為快速冷凍樣品和低溫條件可以很好地保留結構並對某些過程進行良好的時間解析度。例如,在細胞過程中的某個時刻快速冷凍細胞和組織可以很好地瞭解這些細胞和組織在該特定細胞過程中的某個時刻的結構和活性。這種斷層掃描有助於以更動態的水平學習細胞及其細胞器。為了便於觀看過程,細胞的每個細胞器都用不同的顏色呈現。冷凍細胞是為了使細胞保持其原始結構。冷凍此類樣品的方法是將它們放置在網格上,在薄層水中將其吸乾,然後將其浸入乙烷中,然後再將其儲存在液氮中。冷凍電鏡斷層掃描用於研究幾乎所有樣品,例如病毒。該工具可以幫助理解病毒的複製狀態,以及病毒可能變成的單個結構。最近的一項研究對病毒的刺突蛋白和刺突蛋白影響病毒的各種結構進行了研究。如今,冷凍電鏡斷層掃描被用於幫助尋找癌症的治療方法,方法是評估蛋白質的構建塊,即鈣粘蛋白,這些蛋白質有助於阻止癌細胞在全身擴散。透過冷凍電鏡斷層掃描獲得的資訊有助於理解和了解許多細胞過程的結構基礎,因此也能理解其功能。
冷凍電鏡斷層掃描存在一些侷限性。主要侷限性是樣品的厚度。樣品必須足夠薄,才能使其凍結良好,以便可以用透射電鏡(TEM)正確地收集它。如果樣品太厚,則必須在溫度仍很低的情況下將其切成更薄的切片,以防止再結晶。獲得影像有兩種方法:一種是透過固定傾斜增量,另一種是透過漸變傾斜增量。漸變傾斜增量更受青睞,這是因為傾斜增量與傾斜角度的餘弦成正比。冷凍電鏡斷層掃描的另一個問題是輻射損傷。為了防止輻射損傷,應在低電子劑量條件下對樣品成像,這導致獲得的 3D 影像解析度更低,並且也限制了冷凍電鏡斷層掃描所需的樣品厚度。
二十面體重建
[edit | edit source]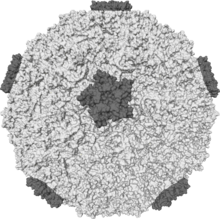
二十面體重建是指冷凍電鏡在闡明具有適當(二十面體)對稱性的顆粒的結構中的應用。二十面體樣品的高內部對稱性使確定對稱元素的位置變得更容易,從而減少了確定樣品 3D 結構所需的影像數量。 [1] 這可能看起來像是對顯微鏡的任意且不相關的應用,但實際上,存在著大量的顆粒包含這種對稱性。二十面體顆粒的例子包括大多數人類病毒,以及一些分子,如十二氫-閉合-十二硼酸根離子 (B12 H122-) 和富勒烯。

許多病毒結構已經透過二十面體重建被預測並隨後透過實驗確定。二十面體屬於高對稱性群 Ih,該群包含 120 個對稱操作,其中最獨特的是六個五重對稱軸。 [2] 該對稱性群的性質對於冷凍電鏡的應用至關重要。 [3]
螺旋重建
[edit | edit source]螺旋重建是一種利用冷凍電鏡來開發某些“絲狀”生物結構的三維結構的方法。只要存在螺旋對稱性,該方法使用冷凍電鏡的 2D 投影影像來生成這些 3D 影像。然而,該方法不能應用於包含“接縫”或“擾動”的結構。有一種稱為不對稱螺旋重建的新方法可以應用於包含“接縫”的螺旋結構。與傳統的螺旋重建方法類似,傅立葉變換影像用於生成層線資料,然後這些資料用於生成 3D 結構。
螺旋重建允許透過一種型別蛋白質分子的規則接觸形成大型基團。螺旋對稱性可以在絲狀病毒(例如,Pf1)中找到,在肌動蛋白、微管蛋白或其他細胞骨架的蛋白質中找到,或者在形成摺疊在圓柱體表面的 2D 晶體的蛋白質中找到,例如乙醯膽鹼受體或 CopA。
2D 與 3D 螺旋重建的基本思想:圖 1 和圖 2。連結:http://www.nysbc.org/facilities/CEM/cryoem-generalinfo.html 透過電子顯微鏡方法觀察蛋白質的 2D 和 3D 影像。
電子晶體學
[edit | edit source]電子晶體學是一種顯微鏡形式,它使用電子束來構建小型固體(如蛋白質)的影像。該過程用於根據電子散射確定和預測蛋白質的結構和排列,這些結構和排列來自二級結構晶體,例如α螺旋或β摺疊。它可以用來研究有機物和無機物,以及蛋白質結構。電子晶體學在許多方面補充了 X 射線晶體學,但也在 X 射線晶體學失敗的地方取得了成功。例如,X 射線晶體學研究需要蛋白質的四級結構,而四級結構往往比二級結構難以獲得。電子晶體學存在一個問題,即它會導致正在分析的蛋白質受到輻射損傷。這阻礙了顯微鏡過程的範圍和功能。為了減少輻射損傷,實施了冷凍固定,在這種情況下,成像是在非常低的溫度(如液氮的溫度)下進行的。當特定蛋白質容易被顯微鏡中的電子變性或損壞時,此資源特別有價值。
晶體結構確定包括兩個步驟:‘求解’,它使用 EM 影像找到大約 0.25 Å 內最重原子的模型;以及‘精修’,它使用選區電子衍射或會聚束電子衍射資料找到大約 0.02 Å 內的所有原子。
使用電子衍射來研究晶體結構始於 1937-1938 年的莫斯科,當時是由 Pinsker 和 Vainshtein 帶領的一組科學家。他們的研究使用了他們自己的電子衍射相機,這些相機具有相對較低的加速電壓來記錄不同材料的電子衍射資料。根據這些資料,他們能夠定位晶體結構中的氫原子,而這在使用 X 射線衍射時無法做到。為了求解未知結構,需要相位資訊,該資訊首先由 Hauptmann 和 Karle 於 1953 年引入,稱為“直接方法”。將直接相位方法與現代計算機結合使用,電子晶體學在晶體和其他分子的結構確定方面取得了重大進展。
有兩種不同的電子衍射技術:1)選區電子衍射 (SAED),它需要近似運動學條件,並適用於單位晶胞尺寸>10 Å 以及薄樣品<200 Å;2)會聚束電子衍射 (CBED),它利用動態效應,並適用於單位晶胞尺寸<10 Å 以及厚樣品>200 Å。
為什麼使用電子?與 X 射線相比,電子與物質的相互作用強度高 10^4-10^5 倍;並且它們在高解析度電子顯微鏡影像中存在相位。
與 X 射線晶體學相比,電子晶體學具有一些關鍵優勢。其中一個優勢是電子晶體學可以分析更小的晶體。這是因為電子與物質的相互作用比 X 射線更強。另一個優勢是電子束可以透過磁透鏡聚焦形成影像,而 X 射線無法形成影像。由於電子與物質相互作用的機制是基於電子檢測晶體中的勢分佈,而 X 射線取決於 X 射線檢測電子密度分佈的機制,因此電子晶體學可以在 X 射線晶體學無法應用的某些情況下使用。例如,晶體中原子的氧化態。
使用電子晶體學來確定結構非常重要,因為它能夠觀察蛋白質的自然形式。透過利用電子晶體學,人們可以在蛋白質所在的結構中觀察脂質-蛋白質雙層中的蛋白質,從而可以更好地確定其功能。
單粒子電子顯微鏡
[edit | edit source]從一系列二維影像重建三維分子影像的技術被稱為電子顯微鏡。由於其易於訪問的特點,它為結構生物化學家提供了許多生物分子結構資訊的深入見解。
為了從這種方法獲得三維結構,必須滿足兩個要求。
1. 蛋白質的合理大小,可以形成大型宏觀分子組裝體,無需使用晶體。2. 分子必須以許多相同的複製存在。
電子斷層掃描產生的解析度較低,噪聲較高。單顆粒電子顯微鏡的主要目標是確定收集到的投影影像之間的幾何關係。在 2008 年,科學家們能夠追蹤多肽鏈的骨架並建立原子模型。單顆粒電子顯微鏡確實能夠以接近原子解析度提供結構資訊。
三維結構將是以下步驟的結果:
1) 樣品製備。這是收集樣品並將其放置在(金屬)板上以產生最佳對比度的步驟。有三種技術用於製備單顆粒電子顯微鏡的樣品。a) 負染色:分子吸附在連續的碳膜上,將分子放入金屬板上進行乾燥。b) 玻璃化:將樣品浸入液態乙烷中以在天然環境中儲存分子,它產生低對比度。(將它們儲存在完全水合的狀態下)玻璃化是**最佳**的標本製備方法,但不適用於異質樣品。c) 冷凍負染色:高對比度影像浸入高離子強度的飽和鉬酸銨溶液中。它適合研究小而異質的樣品。
2) 粒子挑選。這是所有過程中最繁瑣的過程之一,因為電子顯微鏡學家必須根據其在方向上的相似性對粒子進行分類和分離;所有這些工作都是手工完成的,以實現最高效率。話雖如此,已經開發了自動挑選程式,但由於信噪比低,它們無法執行任務。此步驟的結果是收集了少量單個粒子影像。

維基百科編輯 _隨機錐形傾斜_。
4) 細化。初步模型用於使用尤拉角計算更好的對齊,即粒子在平面內旋轉/未旋轉的位移。從細化後的資料中,重建了分子的新三維結構。當應用測試負溫度時,會發生過度細化的風險。
單顆粒電子顯微鏡比電子晶體學具有經濟上的優勢。與晶體學不同,它不需要晶體——這意味著樣品不需要是純淨的——這需要更多的工作才能實現。另一個優點是單顆粒電子顯微鏡只需要很少的樣品,這總是讓研究人員感到高興。
然而,單顆粒電子顯微鏡的缺點之一是難以確定密度圖的解析度及其準確性。由於沒有方法來檢查準確性,因此通常只能做的事情是重複該過程並將結果與以前的結果進行比較。因此,結果只能根據一致性而不是準確性進行評估。
蛋白質-脂質陣列[edit | edit source]
電子晶體學已被用於透過分析稱為蛋白質-脂質陣列的樣品陣列來研究膜蛋白。這些陣列可以以多種不同的方式排列,並提供許多優點和缺點。對膜蛋白產生最有用密度圖的兩種形式是二維片狀晶體陣列和管狀晶體陣列。它們非常精確,可以揭示有關單個脂質分子和蛋白質側鏈的資訊,這是由於對片狀或管狀陣列影像中的許多晶胞進行了平均,從而增強了較差的信噪比。
在過去的幾十年中,從去垢劑溶解的純化蛋白質中建立管狀和片狀蛋白質-脂質陣列的方法有了很大的進步,但在篩選方面沒有像易於操作的機器人篩選這樣的進步。儘管該領域進行了大量研究,但他們仍然缺乏快速可靠地檢查樣品質量的能力。幾個實驗室透過增強現有軟體,改進了這些晶體的分析方法,使該過程更加高效和使用者友好。
儘管它們的螺旋陣列對稱性在確定結構方面具有很大的優勢,但管狀晶體沒有像片狀晶體那樣廣泛使用。管狀晶體的一幅影像包含許多相同分子的不同檢視,足以在三維空間中重建它,而無需傾斜。為了糾正變形,管狀晶體以與片狀晶體類似的方式進行處理,其中兩個重複長度被分成更短的片段,然後與參考結構進行比較,以確定識別完整結構所需的引數。此過程傳統上使用傅立葉-貝塞爾方法來評估資料,使它們能夠分析螺旋對稱性保持的程度以及垂直於管軸的二重對稱性,從而可以校正結構不同層級的聚焦變化。還開發了一種不使用傅立葉-貝塞爾方法,而是將片段視為單個粒子串的替代方法。這種替代方法正變得越來越流行,用於從無序的螺旋聚合物(如管狀蛋白質-脂質晶體)中提取結構資訊。這顯示出從管狀結構確定接近原子解析度的結構的巨大潛力。
電子晶體學涉及的方法包括自由捕獲以建立不同的構象狀態。為了冷凍捕獲標本,將電子顯微鏡網格放入液氮冷卻的乙烷中,乙烷使標本快速冷卻,從而可以捕獲脂質-蛋白質陣列的結構,該結構的壽命為毫秒或更長。冷凍捕獲的蛋白質可以透過光或適當的配體啟用。近年來,氦冷卻頂置冷凍捕獲的發展導致資料收集影像更加清晰,並有望更詳細地描述蛋白質-脂質雙層的門控機制。
此外,分子斷層掃描用於探索蛋白質的功能環境。透過從一系列傾斜檢視中拍攝影像,可以建立整個場景的三維影像,從而建立更好的三維影像。
單分子方法[edit | edit source]
這是一種觀察單個分子動力學行為以確定單個分子水平的作用機制,以及識別、分類和比較細胞內亞群和亞結構的方法。為了表徵分子結構的動力學,科學家們觀察單個分子的即時軌跡;透過觀察其中許多分子,可以計算出總體上動力學特性的直方圖。
與單分子方法相比,X射線晶體學或核磁共振提供了詳細的結構檢視,但受到靜態分子檢視和整體平均值的限制。
1. 單分子操作:在這種方法中,分子連線到外部探針,該探針對分子施加定義的力或扭矩,以表徵其機械特性。這種方法也稱為原子力顯微鏡 (AMF)。因為細胞被視為一個工廠,其中許多過程是由專門的機器完成的,這些機器將化學能轉化為力、扭矩和機械功——探針將探測到這種動力學和機制。這種方法最近被用來研究 RNA 分子的摺疊和展開以及催化這些反應的酶,以及研究 RNA 聚合酶。
2. 單分子檢測:分子在兩個位置用熒游標記,以“供體”和“受體”的形式存在,它們可以進行熒光共振能量轉移 (FRET)。然後可以觀察分子的軌跡,關於探針熒光強度的變化或關於 FRET 的變化。這種方法的另一個名稱是熒光方法。這是一種強大的方法,可以研究分子的動態行為、它們的穩定性以及追蹤粒子在細胞內外移動。例如,這種方法被用來研究核糖體在翻譯過程中的多種相互作用。
在上述兩種方法中,熒光檢測方法更受研究人員的青睞,因為它需要更簡單的儀器,但缺點是儀器收集的光子有限。
參考文獻- [edit | edit source]
- ↑ Jiang, Wen, Zongli Li, Zhixian Zhang, Christopher R. Booth, and Matthew L. Baker. "Semi-automated Icosahedral Particle Reconstruction at Sub-nanometer Resolution." Journal of Structural Biology . 136. (2001): 214-225. Print.
- ↑ Miessler, Gary. Inorganic Chemistry. 3rd ed. Dehli: Pearson Education in South Asia, 2007. Print.
↑ Fuller, S.D., and S.J. Butcher. "Three-Dimensional Reconstruction of Icosahedral Particles-The Uncommon Line." Journal of Structural Biology . 116. (1996): 48-55. Print.
Yifand Cheng and Thomas Walz. 模板:單顆粒電子顯微鏡中接近原子解析度的出現
Yoshinori Fujiyoshi and Nigel Unwin. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2651081/ 2008
Heel, Marin Van. http://sbio.uct.ac.za/Sbio/Arvind/Structure/Review_MvH.pdf 2006
Unknown. http://www.answers.com/topic/cryo-electron-microscopy. 2007
絕對天文學。 http://www.absoluteastronomy.com/topics/Electron_crystallography 2009
紐約結構生物學中心 http://www.nysbc.org/facilities/CEM/cryoem-generalinfo.html
Thomas E. Weirich,János L. Lábár,鄒曉冬 http://books.google.com/books?id=rAocx9cElUcC&pg=PA3&lpg=PA3&dq=electron+crystallography&source=bl&ots=8rpqKYGhsK&sig=roVEpejLT5obY4Pi7UZthhn5-Wk&hl=en&ei=xpzaSqK3JYjYtgPHwJCyCQ&sa=X&oi=book_result&ct=result&resnum=3&ved=0CBQQ6AEwAg#v=onepage&q=&f=false
Cheng Y,Walz T。 http://www.ncbi.nlm.nih.gov/pubmed/19489732
什麼是電子晶體學 - 鄒曉冬 http://www.nanomegas.com/files/ElectronCrystallographyPRINCIPLES.pdf
在單一生物化學:當少即是多 http://www.annualreviews.org/doi/abs/10.1146/annurev.biochem.012108.120952?journalCode=biochem
