普通化學/各種元素的化學/第 14 族
第 14 族 (IVA) 包括 碳、矽、鍺、錫 和 鉛。碳是非金屬,矽和鍺是類金屬,錫和鉛是金屬。
碳族元素具有 4 個價電子,傾向於形成共價化合物。隨著質量和原子半徑的增加,這些元素變得越來越金屬化,熔點和沸點也越來越低。
第 14 族元素很難形成氣態氫化合物。這些化合物要麼不穩定,要麼易燃。除了鉛之外,所有元素都能在 +4 氧化態下形成氧化物、硫化物和鹵化物。+4 氧化態在碳、矽和鍺中占主導地位;錫中同時出現 +2 和 +4 氧化態,鉛中以 +2 氧化態為主。所有這些元素都形成 +4 態的鹵化物,它們是共價的。
碳化合物比矽、鍺、錫或鉛的類似化合物更 共價。更重要的是,碳可以與自身或其他元素形成雙鍵甚至三鍵,形成其他重元素無法形成的化合物,如乙炔 (C2H2)。矽和該族的其他重元素只能形成單鍵。
因此,二氧化碳 CO2 在常溫下是氣體,因為碳和氧之間的雙鍵形成了單個分子,但二氧化矽 SiO2 形成一種稱為石英的堅硬岩石,因為它是一種 共價網路固體。每個矽原子透過單鍵與四個不同的氧原子鍵合,每個氧原子與兩個矽原子鍵合。鍺、錫和鉛的氧化物具有類似的性質。二氧化碳溶解在水中形成碳酸,碳酸是一種弱酸,與鹼反應形成碳酸鹽;該族的其他元素的氧化物在水中幾乎不反應。
由於碳在化學中具有無與倫比的重要性,因此它是我們研究第 14 族元素的重點。 |
碳是一種非常重要的元素。它在地球和大氣中含量豐富,並且存在於構成所有生物的物質中。碳具有許多使其與其他元素不同的性質,因此值得深入研究。

同素異形體是純元素的不同形式。碳有幾種同素異形體,其中三種很常見。
- 無定形碳是煤和炭黑。碳分子以共價鍵結合,但沒有順序或排列。
- 石墨發生在碳形成扁平共價網路時。這些扁平的“片層”彼此之間沒有鍵合,使它們可以自由滑動。石墨構成鉛筆中的“鉛”。
- 金剛石發生在碳形成三維共價網路時。金剛石與石墨和無定形碳大不相同。它們是透明的、閃閃發光的,並且非常堅硬。金剛石只能在高溫和高壓下形成。
碳還有幾種稀有且奇特的同素異形體,包括
- 富勒烯,或稱巴基球,是球形的碳球。共價鍵將碳原子連線成足球狀圖案,看起來很像巴克明斯特·富勒的球形穹頂。最常見的富勒烯具有 C60 的分子式。富勒烯足夠大,可以讓一個小原子被困在裡面。
- 籠狀石墨在隕石撞擊地球時形成。
- 碳奈米管是由碳製成的非常小但堅硬的管子。它們是在實驗室中製造的,是研究的主題。
請記住,同素異形體僅由一種元素組成。在這種情況下,這些同素異形體僅包含碳原子,不包含其他元素。
雖然碳主要以其有機化合物而聞名,但它確實形成了許多重要的無機化合物。
碳的氧化物僅包含碳原子和氧原子。有兩種氧化物很常見
- 一氧化碳 (CO):當含碳燃料在氧氣有限的情況下燃燒時釋放的有毒氣體。
- 二氧化碳 (CO2):自然存在於空氣中,但含量過多被認為是汙染。動物撥出二氧化碳,植物吸收二氧化碳。它略帶酸性。二氧化碳在固態時為“乾冰”。
還有其他可能形成的氧化物,但它們不穩定或不自然

- 二氧化三碳 (C3O2):由雙鍵組成,末端為氧。O = C = C = C = O。它分解成二氧化碳和二氧化碳。
- 二氧化碳 (C2O):反應性很強。僅包含雙鍵,但末端碳有一個非鍵合對。
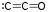
- 三氧化碳 (CO3):存在於三種不同的形狀中,非常不穩定
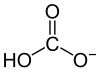
碳酸是由二氧化碳溶解在水中形成的。它由以下反應給出

碳酸鹽 和 碳酸氫鹽 是碳形成的兩種離子。
它們的化學式分別是 CO32- 和 HCO3-。
離子化合物
[edit | edit source]除了氧陰離子(碳酸鹽和碳酸氫鹽)外,碳還可以形成幾種其他的離子。

- 氰化物 (CN-)
- 氰酸根 (OCN-)
- 硫氰酸根 (SCN-)
- 碳化物 (C22- 和 C34-)
氰化氫是一種極其危險的氣體,會干擾細胞代謝導致死亡。它曾被用於處決和種族滅絕,最臭名昭著的是在納粹大屠殺期間。 |
合金
[edit | edit source]碳被用於一些合金中,合金是金屬的混合物。如果將少量(按重量計 0.2% 到 2.1%)的碳混合到鐵中,就會得到鋼。
有機化合物
[edit | edit source]
含有碳的化合物(上述無機化合物除外)被認為是有機的。它們曾經被認為只由生物體產生,但後來在實驗室中被人工合成。大多數有機化合物除了碳之外還含有氫。
許多物質都是有機化合物。聚合物是有機化合物,由包含碳和其他原子的重複模式的長鏈組成。塑膠、橡膠和尼龍都是有機聚合物。碳氫化合物是隻含有氫和碳的化合物,甲烷就是一個簡單的例子。原油是各種混合在一起的碳氫化合物的泥漿。丙烷、丁烷和辛烷是眾所周知的用作燃料的碳氫化合物。也許最有趣的有機化合物型別是生物分子。碳水化合物、蛋白質、脂類(脂肪)和核酸(如 DNA)是最基本的生物分子。它們也是聚合物(脂類除外),由長鏈的小的重複化學物質透過鍵合在一起形成。生物分子構成了構成所有生物體的活細胞中發現的化學物質。
有機化學和生物化學是十分廣泛而深入的學科。它們遠遠超出了普通化學的範圍。幸運的是,你對普通化學的知識足以開始華夏公益教科書的有機化學 和 生物化學,如果你感興趣的話。
矽
[edit | edit source]
矽存在於半導體中,半導體是所有電子裝置的基礎。它的電子構型使它能夠捐贈或接受電子。當純矽被“摻雜”具有比矽更多或更少電子的元素時,輕微不純的矽就變成了半導體。這些物質透過充當開關來構成複雜的電子裝置,該開關可以根據電訊號開啟或關閉。
矽在自然界中不以遊離狀態存在;它最常見於二氧化矽(包括非常常見的岩石石英和大多數沙粒)和矽酸鹽中。大多數矽酸鹽是不溶的。所謂的“神奇巖石”與溶解在水中的矽酸鈉發生反應,然後與一些溶解的金屬鹽的離子發生反應,形成岩石狀矽酸鹽柱。
二氧化矽是一種堅硬的物質,只有在高溫下才能熔化,它的化學性質與二氧化碳截然不同,二氧化碳在凍結成乾冰之前是氣體。熔融二氧化矽可以鑄造成玻璃,玻璃是一種堅硬而有用的材料,能抵抗除氟、氫氟酸和強鹼以外幾乎所有化學物質的侵蝕。玻璃在家庭容器和飲具中非常有用,因為它耐化學物質、耐熱,並能抵抗微生物的侵蝕。玻璃如果純淨或含有某些化學物質,可以非常透明,或者可以呈現出迷人的顏色,使其成為藝術品的首選材料。一些小型生物將海中的溶解二氧化矽轉化為它們的殼來建立結構。種類繁多的矽化合物被稱為矽樹脂,具有廣泛而多樣的用途。
二氧化矽嚴格來說不是毒藥,但作為一種研磨劑,如果食用或吸入,可能會磨損組織而造成損傷。石棉是一種矽酸鹽(也是二氧化矽的衍生物),尤其是在肺部會分解成二氧化矽,並造成巨大損害。 |

其他
[edit | edit source]鍺是另一種用於半導體的元素。在電晶體普及之前,鍺二極體在無線電中被大量使用。
錫被認為是一種“差金屬”。它在標準狀態下有兩種同素異形體:灰錫 和 白錫。灰錫具有非金屬特性,而白錫是金屬。錫經常被用作合金。“錫罐”實際上是鍍錫的鋼罐,以防止腐蝕。白錫是一種主要由錫組成的銅錫合金。青銅是一種主要由銅組成的銅錫合金。焊料是錫鉛合金,因其熔點低而被用於連線電線。
鉛是一種重金屬,呈灰色。它曾被廣泛使用,但現在已知如果攝入,它會成為神經毒素。運水管以前用鉛製成,但現在用銅或塑膠製成,因為鉛可能會汙染水。鉛化合物,尤其是易溶於水(如醋酸鉛,在羅馬時代曾用作葡萄酒的防腐劑和甜味劑)或胃酸(如以前用於油漆中的氧化鉛)或以氣態或液態形式(如以前用於汽油中的四乙基鉛)和鉛粉都是非常危險的。鉛在食品、油漆和汽車燃料中的使用現在幾乎在世界各地都被禁止。
鉛化合物和蒸氣是陰險的毒物,會積聚在大腦中,造成學習障礙和人格障礙。 |
鉛水晶玻璃中含有氧化鉛,但它與二氧化矽緊密結合,因此不易逸出。鉛筆“芯”實際上不是鉛,而是無害的石墨(實際上是碳)與粘土結合在一起。鉛仍然在汽車電池(其中含有比鉛更危險的硫酸)和核用途(作為比鉛金屬更危險的輻射遮蔽)中發揮作用。
| 鉛氧化物很容易被還原。 | |
| 鉛不溶於鹽酸或硫酸,但會溶於硝酸,因為硝酸是一種強氧化劑。 | |
| 加入鹼性溶液中,氧化鉛(II)會形成亞鉛酸鹽離子。 | |
| 亞鉛酸鹽在氯化時會形成氧化鉛(IV)。 | |
| 將氧化鉛(IV)加入鹼性溶液中會形成鉛酸鹽離子。 |