結構生物化學/催化
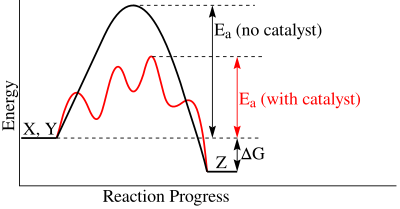
酶最常見的功效之一是催化反應的能力。在反應過程中,反應物必須克服活化能才能生成產物。所需的活化能決定了反應進行所需的時間。活化能越低,反應速率就越快。酶在催化反應中的作用是穩定中間物種,該物種處於活化能的最高點,從而降低活化能。酶與中間態互補,而不是與底物互補。如果酶與底物結合,它實際上會增加活化能。無論有無催化酶,達成的平衡都是相同的。然而,影響的是達到平衡的時間和速率。
一般來說,底物濃度越高,酶越容易與其結合。透過繪製產物生成量隨時間的變化曲線,斜率表示底物飽和之前反應發生的速率。該值稱為 V0。增加底物濃度將增加 V0。然而,當底物濃度過高時,反應將不再加速,到達一個臨界點。該點稱為最大速度 Vmax。每種酶都有其獨特的 Vmax 值。酶的另一個重要特徵是 Km 值,定義為 Vmax 一半時的底物濃度。Km 對每種酶也是獨特的。產物生成速率稱為 Kcat。將 Kcat 除以 Km 得到酶的效率常數,該常數說明了反應進行的速度以及酶找到底物的可能性。有關更多資訊,請參閱催化。
磷醯基轉移反應的一個關鍵特徵是,它們通常具有極慢的非酶促速率,因此需要使用催化劑來大幅度加速反應速率。發生在磷酸酯磷原子上的反應也構成了許多生命系統中最重要和最基本過程的化學基礎,因為它們允許透過核酸遺傳資訊的傳遞,並且也負責利用能量偶聯驅動維持細胞健康和活力的熱力學不利反應。磷醯基轉移反應在代謝途徑和訊號轉導中也發揮著重要作用。
這些磷醯基轉移反應中催化的一個可能機制是磷酸單酯的水解。隨著 pH 值的降低,水解速率往往會顯著增加;這種變化表明磷酸單酯的質子化形式比磷酸單酯二陰離子反應更快。這些反應通常在酶的幫助下快速進行,這可以歸因於幾個因素。例如,親核試劑的活化可以透過三種方式之一完成;親核試劑的位置可以透過增加甚至減少其親核性來影響親核試劑。另一種方法是減少靜電斥力。酶最重要的特徵之一是它們利用結合相互作用和定位基團來進行催化的能力。酶能夠直接完成這一點的能力直接將酶的特異性與催化結合起來。
在磷醯基轉移反應中,親核試劑與磷原子以及離去基團的排列也很重要,以便攻擊磷原子。另一個可能有助於單酯反應催化的因素是穩定潛在離去基團上的負電荷。還發現,磷醯基轉移反應的過渡態可以根據化合物是磷酸單酯、二酯還是三酯,是鬆散的、緊密的或同步的。磷酸單酯通常通過鬆散的過渡態進行,二酯透過同步的過渡態進行,而三酯透過緊密的過渡態進行。
磷醯基轉移反應中使用的酶中正電荷官能團的存在也會影響反應與轉移磷醯基的氧原子的相互作用。
- Berg, Jeremy; Tymoczko, John; Stryer, Lubert. 生物化學,第 6 版。W.H. Freeman and Company. 2007.
Jonathan K. Lassila, Jesse G. Zalatan 和 Daniel Herschlag。“生物磷醯基轉移反應:理解機制和催化”。http://www.annualreviews.org/doi/full/10.1146/annurev-biochem-060409-092741?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%3dpubmed
https://wikibook.tw/wiki/Structural_Biochemistry/Enzyme
https://wikibook.tw/wiki/Structural_Biochemistry/Enzyme/Activation_energy
https://wikibook.tw/wiki/Structural_Biochemistry/Enzyme_Catalytic_Mechanism/Catalysis