有機化學/烯烴
烯烴的命名方式與烷烴類似,但將“-烷”字尾改為“-烯”。如果烯烴只含有一個雙鍵,並且該雙鍵為末端鍵(雙鍵位於分子的末端或其他末端),則不需要在名稱前新增任何數字。
丁烷:C4H10(CH3CH2CH2CH3)
丁烯:C4H8(CH2=CHCH2CH3)
如果雙鍵不是末端鍵(如果它位於鏈的中間碳上),則應對碳進行編號,使兩個雙鍵碳中的第一個具有最小的編號,並將該編號與“-烯”字尾用連字元連線,如下所示。
正確:戊-2-烯(CH3CH=CHCH2CH3)
不正確:戊-3-烯(CH3CH2CH=CHCH3)
第二個不正確,因為將公式水平翻轉會導致烯烴的編號更低。
如果烯烴中有多個雙鍵,則應在分子名稱中對所有鍵進行編號,即使是末端雙鍵也是如此。編號應從最低到最高,並用逗號分隔。IUPAC 數字字首用於指示雙鍵的數量。
辛-2,4-二烯:CH3CH=CHCH=CHCH2CH2CH3
癸-1,5-二烯:CH2=CHCH2CH2CH=CHCH2CH2CH2CH3
請注意,上面的“2-4”編號產生了兩個雙鍵僅被一個單鍵隔開的分子。這種條件下的雙鍵被稱為“共軛”,它們代表構象的增強穩定性,因此在許多情況下和組合中,它們在能量上被認為是優先的反應物。
在立體化學中,我們之前討論過順反異構體符號,其中順式表示同一側,反式表示相對側。然而,烯烴可能會出現一個獨特的問題,因為順反異構體符號有時會失效。首先要記住的是,烯烴是平面的,並且鍵沒有旋轉,正如我們稍後將討論的。因此,當取代基位於雙鍵的一側時,它會保持在該側。
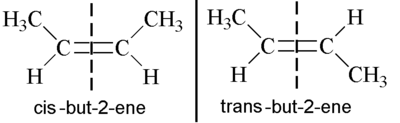
上面的例子非常直截了當。在左側,我們有兩個甲基位於同一側,因此它是順-丁-2-烯。在右側,它們位於相對側,因此我們有反-丁-2-烯。因此在這種情況下,順反異構體符號有效,事實上,這些是正確的名稱。

從上面的例子來看,你將如何使用順式和反式?哪一個是同一側,哪一個是相對側?當烯烴具有 3 或 4 個不同的取代基時,必須使用所謂的 EZ 命名法,來自德語單詞 Entgegen(相對)和 Zusammen(相同)。
|
E:Entgegen,雙鍵的相對側 |
讓我們從 (Z)-3-甲基戊-2-烯開始。我們首先將烯烴分成左右兩部分。在每側,我們將一個取代基指定為高優先順序取代基或低優先順序取代基。優先順序基於取代基的原子序數。因此,在左側,氫的優先順序最低,因為它的原子序數是 1,而碳的原子序數是 6,所以優先順序更高。
在右側,我們在頂部和底部都有碳取代基,因此我們繼續到下一個鍵。在頂部,還有另一個碳,但在底部,有一個氫。因此,頂部具有高優先順序,底部具有低優先順序。
因為兩側的高優先順序位於同一側,所以它們是 Zusammen(作為助記符,可以想象 'Zame Zide')。
現在讓我們看一下 (E)-3-甲基戊-2-烯。在左側,我們在同一側具有相同的取代基,因此優先順序與 Zusammen 版本相同。然而,取代基在右側反轉,高優先順序取代基位於底部,低優先順序取代基位於頂部。因為高優先順序和低優先順序在左右兩側相反,所以它們是 Entgegen,或相反。
這個系統需要一些時間來習慣,並且通常給出一個烯烴的名稱比給出一個名稱寫出一個烯烴更容易。但是,經過一些練習,你會發現它非常容易。
| (Z)-丁-2-烯 | (E)-丁-2-烯 |
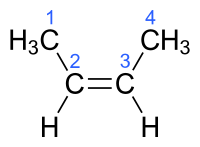 |

|
| 順-丁-2-烯 | 反-丁-2-烯 |
在一定程度上,可以將 Z 型構型視為順式異構體,將 E 型構型視為反式異構體。這種對應關係僅在兩個碳原子具有相同取代基時才是精確的。
一般來說,只有在每個雙鍵碳原子都具有氫原子(即 R-CH=CH-R')時才應使用順反異構體。
烯烴是含有至少兩個 sp2 雜化的碳原子的碳與氫鍵合的分子。也就是說,至少有一個碳-碳雙鍵,其中碳原子除了在σ(西格瑪)鍵中共享一對電子外,還在它們之間共享一對電子,形成π(派)鍵。
脂肪族烯烴的通式為:CnH2n -- 例如 C2H4 或 C3H6
由於π鍵的特性,烯烴在兩個原子之間的雙鍵周圍的旋轉非常有限。為了使烯烴結構旋轉,π鍵必須首先斷裂 - 這需要每摩爾約 60 或 70 千卡的能量。因此,烯烴根據每個原子位於鍵的哪一側具有不同的化學性質。
例如,2-丁烯存在兩種非對映異構體
| (Z)-丁-2-烯 | (E)-2-丁烯 |
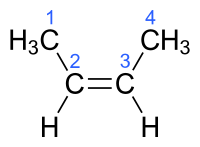 |

|
| 順-丁-2-烯 | 反-丁-2-烯 |
觀察氫氣加成到 1-丁烯、(Z)-2-丁烯和 (E)-2-丁烯的反應,我們可以看到所有產物都是丁烷。反應之間的區別在於每個反應都有不同的能量:1-丁烯為 -30.3 千卡/摩爾,(Z)-2-丁烯為 -28.6 千卡/摩爾,(E)-2-丁烯為 -27.6 千卡/摩爾。這說明丁烯異構體的三種種類在穩定性方面存在差異,這是由於它們還原後可以釋放的能量不同造成的。
可以根據以下概念估算烯烴的相對穩定性
- 內烯烴(雙鍵不在末端碳上)比末端烯烴(雙鍵在末端碳上)更穩定。
內烯烴比末端烯烴更穩定,因為它們與鏈上的更多碳原子相連。由於末端烯烴位於鏈的末端,雙鍵僅與一個碳原子相連,被稱為伯(1°)。伯碳是最不穩定的。在鏈的中間,雙鍵可以與兩個碳原子相連。這被稱為仲(2°)。最穩定的將是叔(4°)。
- 通常,烯烴中 sp2 雜化的碳上連線的烷基越多且越龐大,該烯烴就越穩定。
- 反式雙鍵比順式雙鍵更穩定。
有幾種方法可以生成烯烴。[1] 這些方法中的一些,例如 Wittig 反應,我們只會在本章中簡要介紹,並在本書的後面更詳細地介紹。現在,知道它們是生成烯烴的方法就足夠了。

滷代烷透過脫鹵化氫轉化為烯烴:消除鹵化氫的元素。脫鹵化氫涉及從帶鹵素的碳原子相鄰的碳原子上去除鹵素原子以及氫原子。它使用 E2 消除機理,我們將在本章末尾詳細討論。滷代烷必須在相鄰碳原子上具有 180° 的氫和鹵素。如果在相鄰碳原子上沒有與鹵素成 180° 的氫,則反應不會發生。毫不奇怪,消除相當於酸分子所需試劑是強鹼,例如:醇性 KOH。
在某些情況下,這種反應會產生單一烯烴,而在其他情況下會產生混合物。例如,正丁基氯只能從 C-2 消除氫,因此只產生 1-丁烯。另一方面,仲丁基氯可以從 C-1 或 C-3 消除氫,因此產生 1-丁烯和 2-丁烯。當可以形成兩種烯烴時,2-丁烯是主要產物。


鄰二滷代烷(在兩個相鄰碳原子上的鹵素,想想“鄰近”)的脫鹵素是合成烯烴的另一種方法。反應可以使用丙酮溶液中的碘化鈉進行,也可以使用乙醇或乙酸溶液中的鋅粉進行。
這種反應也可以用鎂在乙醚中進行,儘管機理不同,因為這實際上產生了一種格氏試劑作為中間體,該試劑會與自身反應並導致消除,從而產生烯烴。

醇透過脫水轉化為烯烴:消除水分子。脫水需要酸的存在和加熱。通常用兩種方法之一進行:將醇與硫酸或磷酸一起加熱到 200°C 的溫度,或者將醇蒸氣在 350-400°C 下透過氧化鋁 Al2O3,氧化鋁在這裡充當路易斯酸。
醇脫水的難易程度:3° > 2° > 1°
當可以形成異構烯烴時,我們再次發現一種異構體占主導地位的趨勢。因此,仲丁醇可以產生 2-丁烯和 1-丁烯,但實際上幾乎只產生 2-異構體
正丁醇生成 2-丁烯說明了脫水的一個特徵,該特徵不是脫鹵化氫共有的:雙鍵可以在與最初帶有 -OH 基團的碳原子相距很遠的位置形成。這個特徵將在後面解釋。主要是因為雙鍵出現位置的確定性更高,脫鹵化氫通常比脫水更受青睞作為製備烯烴的方法。
炔烴還原到雙鍵階段可以產生順式烯烴或反式烯烴,除非三鍵在鏈的末端。哪個異構體占主導地位取決於還原劑的選擇。
用鈉或鋰在液氨中還原炔烴得到主要是反式烯烴。用多種不同的催化劑氫化炔烴幾乎完全得到順式烯烴(高達 98%):一種專門製備的鈀,稱為 Lindlar 催化劑;或一種硼化鎳,稱為 P-2 催化劑。
因此,這些反應中的每一個都具有高度的立體選擇性。炔烴順式還原的立體選擇性一般歸因於兩個氫原子附著在催化劑表面上的炔烴同側;據推測,這種相同的立體化學適用於末端炔烴的氫化,末端炔烴不能產生順式和反式烯烴。
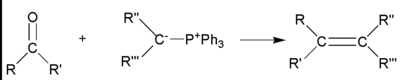
在繼續討論反應之前,我們需要繞道討論一個在烯烴反應中非常重要的主題,“馬氏規則”。這是俄羅斯人弗拉基米爾·馬爾科夫尼科夫在 1869 年提出的一個簡單規則,當時他展示了 HBr 加成到烯烴的取向。
他的規則指出:“當不對稱烯烴與鹵化氫反應生成滷代烷時,氫原子加成到烯烴中具有較多氫取代基的碳原子,鹵素加成到烯烴中具有較少氫取代基的碳原子”(這條規則通常被比喻為“富人更富,窮人更窮”。也就是說,氫原子最多的碳原子得到另一個氫原子,氫原子最少的碳原子得到鹵素)。
這意味著親電試劑-親核試劑對的親核試劑與最有利於碳正離子或過渡態中部分正電荷的位置相連。
這裡 Br 連線到中間碳而不是末端碳,這是由於馬氏規則,這種產物被稱為馬氏產物。
馬氏產物
[edit | edit source]遵循馬氏規則的反應的產物被稱為馬氏產物。
馬氏加成
[edit | edit source]馬氏加成是一種遵循馬氏規則的加成反應,生成馬氏產物。
反馬氏加成
[edit | edit source]某些反應會生成與馬氏產物相反的產物,稱為反馬氏產物。也就是說,氫最終位於雙鍵上取代程度更高的碳原子上。我們稍後將討論的硼氫化/氧化反應就是一個例子,在過氧化物中進行的反應也是如此。
馬氏規則的現代版本通常解釋了“反馬氏”行為。原始的馬氏規則預測,在雙鍵上新增的氫(親電試劑)最終將位於具有更多氫的碳上。將其推廣到所有親電試劑,實際上是親電試劑最終位於具有最多氫的碳上。通常氫起著親電試劑的作用;但是,氫在某些反應中也可以作為親核試劑。以下是對馬氏規則的擴充套件更通用
"當烯烴發生親電加成時,親電試劑加成到具有最多氫取代基的碳原子上。親核試劑加成到取代程度更高的碳原子上。"
或者更簡單地說
"第一個加成的物質加成到具有最多氫的碳原子上。"
一些反應可靠地生成反馬氏產物這一事實實際上是有機化學中一個強大的工具。例如,在我們下面討論的反應中,我們將展示兩種從烯烴中生成醇的不同方法:氧汞化-還原和硼氫化/氧化。氧汞化生成馬氏產物,而硼氫化生成反馬氏產物。這為有機化學家提供了選擇產物的選擇,而不必侷限於可能不是最理想的單一產物。
為何有效
[edit | edit source]馬氏規則之所以有效,是因為碳正離子中間體的穩定性。實驗表明碳正離子是平面分子,碳具有三個取代基,彼此之間成 120° 角,並且有一個空空的 *p* 軌道垂直於它位於第三個平面上。*p* 軌道延伸到三取代平面的上方和下方。
這導致了一種稱為超共軛的穩定效應。超共軛是指當一個未填充(反鍵或空)C-C π 軌道和一個填充的 C-H σ 鍵軌道彼此相鄰時發生的情況。結果是填充的 C-H σ 軌道與未填充的 C-C π 軌道相互作用並穩定分子。分子取代程度越高,超共軛的機會就越多,因此分子越穩定。
另一種穩定效應是誘導效應.
規則的例外
[edit | edit source]馬氏規則有一些例外,這些例外對於有機合成非常重要。
- 過氧化氫中的 HBr:由於自由基的形成以及其反應機理,烷基自由基在中間原子處形成,在那裡它最穩定,並且氫在那裡附著。請注意,氫加成是第二步,與上面的例子不同。
加成反應
[edit | edit source]硼氫化
[edit | edit source]硼氫化是烯烴中非常有用的反應,與其說是最終產物,不如說是進一步反應的中間產物。我們將在下面討論的主要反應是硼氫化/氧化反應,它實際上是一個硼氫化反應,然後是一個完全獨立的氧化反應。

BH3 的加成是一個協同反應,因為幾個鍵同時斷裂和形成。硼氫化發生在所謂的順式加成中,因為硼及其氫原子同時附著在烯烴的同一側。正如您從影像中心過渡態中看到的那樣,這會在兩個烯烴碳原子以及硼及其氫原子之間產生一種盒子。在最後一步中,硼與其另外兩個氫原子一起保持附著在其中一個碳原子上,而另一個氫原子則附著在相鄰的碳原子上。
這種描述相當充分,但是反應實際上會繼續發生,-BH2 會繼續與其他烯烴反應生成 R2BH,然後再次反應,直到你最終得到硼原子附著在 3 個烷基上的絡合物,即 R3B。
然後在其他反應中使用這種三烷基硼絡合物來生成各種產物。
 |
 |
實際上,硼烷不能作為 BH3 穩定存在。在這種構型中,硼只有 6 個電子,而它需要 8 個電子,因此它在自然狀態下實際上會形成左圖所示的 B2H6 絡合物。
此外,通常不用 B2H6 本身,而是用右圖所示的與四氫呋喃 (THF) 形成的絡合物形式的 BH3。無論哪種情況,反應的結果都是一樣的。
硼氫化/氧化
[edit | edit source]
使用試劑二硼烷,(BH3)2,烯烴發生硼氫化生成烷基硼烷,R3B,在氧化後生成醇。反應過程簡單方便,產率極高,產物是其他方法難以從烯烴中獲得的產物。
二硼烷是假設的 BH3(硼烷)的二聚體,在我們關注的反應中,其作用類似於 BH3。事實上,在四氫呋喃(用於硼氫化的溶劑之一)中,試劑以單體形式存在,以與溶劑形成酸鹼絡合物。
硼氫化涉及 BH3(或後續階段中的 BH2R 和 BHR2)與雙鍵的加成,其中氫附著在一個雙鍵碳原子上,而硼附著在另一個碳原子上。然後烷基硼烷可以發生氧化,其中硼被 -OH 取代。
因此,硼氫化-氧化的兩步反應過程實際上允許在碳-碳雙鍵上加成 H-OH 元素。
反應在醚中進行,通常是四氫呋喃或“二甘醇二甲醚”(二甘醇二甲醚,CH3OCH2CH2OCH2CH2OCH3)。二硼烷在四氫呋喃溶液中市售。烷基硼烷未分離出來,而是直接用鹼性過氧化氫原位處理。
然後,硼氫化-氧化將烯烴轉化為醇。加成具有高度的區域選擇性;然而,這裡的主要產物與氧汞化-去汞化或直接酸催化的水合反應形成的產物完全相反。
硼氫化-氧化過程生成與反馬氏規則加成水到碳-碳雙鍵相對應的產物。
3,3-二甲基-1-丁烯的反應說明了該方法的一個特殊優勢。顯然,在硼氫化過程中不會發生重排,因為碳正離子不是中間體,因此該方法可以在沒有經常伴隨著其他加成反應的複雜性的情況下使用。1,2-二甲基環戊烯的反應說明了合成的立體化學:硼氫化-氧化涉及整體順式加成。

烯烴在水存在下與醋酸汞反應生成羥基汞化合物,這些化合物在還原後生成醇。
第一階段,氧汞化,涉及-OH 和 -HgOAc 加成到碳-碳雙鍵。然後,在還原中,-HgOAc 被 -H 取代。反應序列相當於烯烴的水合,但比直接水合具有更廣泛的適用性。
氧汞化/還原是一個快速便捷的兩步法過程,在溫和條件下進行,並且通常能以超過 90% 的優異產率獲得產物。在室溫下,將烯烴新增到四氫呋喃溶劑稀釋的醋酸汞水溶液中。反應通常在幾分鐘內完成。有機汞化合物不分離,而是原位用硼氫化鈉 NaBH4 還原。(汞以元素汞球的形式回收。)
氧汞化/還原具有高度的區域選擇性,生成與水按馬氏規則加成到碳-碳雙鍵相對應的醇。
氧汞化涉及親電加成到碳-碳雙鍵,其中汞離子作為親電試劑。氧汞化步驟中不存在重排以及高度的立體專一性(通常是反式)表明開放碳正離子不是中間體。相反,有人提出,形成了類似於鹵素加成中涉及的溴鎓離子和氯鎓離子的環狀汞鎓離子。1971 年,奧拉報道了製備此類汞鎓離子的穩定溶液的光譜證據。
汞鎓離子被親核溶劑水攻擊,在本例中生成加成產物。這種攻擊是背面攻擊(除非被某些結構特徵阻止),淨結果是反式加成,就像鹵素加成一樣。因此,攻擊屬於 SN2 型別;然而,加成的取向表明親核試劑連線到取代度更高的碳上,就好像存在一個自由的碳正離子中間體一樣。正如我們將看到的,這種不穩定的三元環反應的過渡態具有很高的 SN1 特徵。
還原通常不是立體專一的,在某些特殊情況下,可能伴隨著重排。
儘管第一階段具有立體專一性,但總體過程一般而言不是立體專一的。重排可能會發生,但不常見。3,3-二甲基-1-丁烯的反應說明了典型中間體碳正離子不存在重排的情況。
狄爾斯-阿爾德反應是一種反應(具體來說是環加成反應),在共軛二烯和取代的烯烴(通常稱為親二烯體)之間進行,形成取代的環己烯體系。即使新形成的環中的一些原子不是碳,該反應也可以進行。一些狄爾斯-阿爾德反應是可逆的;環狀體系的分解反應被稱為逆狄爾斯-阿爾德反應。

狄爾斯-阿爾德反應通常被認為是有機化學中更有用的反應之一,因為它只需要很少的能量就能生成環己烯環,這在許多其他有機反應中很有用。
幾乎可以肯定地涉及協同的單步機制;兩個新的碳-碳鍵在同一個過渡態中部分形成,儘管不一定形成程度相同。狄爾斯-阿爾德反應是環加成的最重要例子。由於反應涉及一個 4 π 電子體系(二烯)和一個 2 π 電子體系(親二烯體),因此被稱為 [4 + 2] 環加成。
烯烴的催化加氫生成相應的烷烴。該反應在壓力下,在金屬催化劑存在下進行。常見的工業催化劑是基於鉑、鎳或鈀,但在實驗室合成中,雷尼鎳(由鎳和鋁的合金製成)經常被使用。
乙烯催化加氫生成乙烷的過程如下
- CH2=CH2 + H2 + 催化劑 → CH3-CH3
大多數烯烴加成反應遵循親電加成機制。一個例子是普林斯反應,其中親電試劑是羰基。
在有機溶劑存在下,將元素溴或氯加成到烯烴分別生成鄰二溴烷烴和鄰二氯烷烴。
溴水溶液褪色是檢測烯烴存在的一種分析方法:CH2=CH2 + Br2 → BrCH2-CH2Br
該反應之所以有效,是因為雙鍵處的電子密度高,導致 Br-Br 鍵中的電子暫時移動,從而產生暫時的感應偶極。這使得最靠近雙鍵的 Br 稍微帶正電,因此成為親電試劑。
將鹵代烴酸(如 HCl 或 HBr)加成到烯烴生成相應的滷代烷烴。
- 這種型別的反應的一個例子是:CH3CH=CH2 + HBr → CH3-CHBr-CH3
如果雙鍵處的兩個碳原子連線到不同數量的氫原子,則鹵素優先存在於氫取代基較少的碳原子上(馬氏規則)。
加成卡賓或類卡賓生成相應的環丙烷
烯烴被大量的氧化劑氧化。在氧氣存在下,烯烴燃燒產生明亮的火焰,生成二氧化碳和水。用氧氣催化氧化或與過酸反應生成環氧化合物。
在臭氧化反應中與臭氧反應導致雙鍵斷裂,生成兩種醛或酮:R1-CH=CH-R2 + O3 → R1-CHO + R2-CHO + H2O
該反應可用於確定未知烯烴中雙鍵的位置。
烯烴的聚合反應是一種經濟上重要的反應,它生成具有高工業價值的聚合物,如塑膠聚乙烯和聚丙烯。聚合反應可以透過自由基機制或離子機制進行。
親核取代反應(SN1 和 SN2)與E1 和 E2 消除反應(在本節後面討論)密切相關,通常最好一起學習這些反應,因為它們在反應機理、優選底物方面存在相似之處,而且這些反應有時會相互競爭。
重要的是要理解,取代和消除反應與特定化合物或混合物無關,而是對某些反應發生的表示。有時,這些機制的組合可能在同一反應中一起發生,或者可能相互競爭,溶劑或親核試劑的選擇等影響因素決定了哪個反應占主導地位。
注意在符號 SN1 和 SN2 中,
|
在親核取代反應中,一個親核試劑會攻擊一個分子,取代另一個親核試劑,而另一個親核試劑則會離開。離開的親核試劑被稱為離去基團。
親核取代反應需要
- 一個親核試劑(例如路易斯鹼)
- 一個帶有離去基團的親電試劑
一個離去基團是一個帶電荷或中性的部分(基團),它會斷裂分離。
SN1 和SN2之間的主要區別之一是SN1反應是一個兩步反應,由離去基團的解離引發。另一方面,SN2反應是一個一步反應,其中進攻的親核試劑由於其對碳的更高親和力和更強的鍵合,迫使離去基團離開。這兩件事在一個步驟中發生。
這兩種不同的機理解釋了SN1 和SN2反應之間反應速率的差異。SN1反應取決於離去基團從碳上的解離。它是速率控制步驟,因此反應速率是一級反應,其速率僅取決於該步驟。
另一方面,在SN2反應中,親核試劑從離去基團的相反方向與反應物結合在一起的單一步驟是其速率的關鍵。因此,速率取決於親核試劑的濃度和反應物的濃度。這兩個濃度越高,碰撞越頻繁。因此反應速率是二級反應
- (其中Nu:是進攻的親核試劑)
主要有三個因素影響SN2反應是否會發生。最重要的因素是結構。即烷基滷代物是在甲基、伯碳、仲碳還是叔碳上。另外兩個決定SN2反應是否會發生的因素是親核試劑的親核性以及反應中使用的溶劑。
SN2反應的結構反應活性CH3X > RCH2X > R2CHX >> R3CX |
烷基滷代物的結構對機理有很大影響。CH3X和RCH2X是SN2反應的首選結構。R2CHX可以在適當條件下(見下文)進行SN2反應,而R3CX很少參與SN2反應,甚至完全不參與。

該反應透過親核試劑從溴原子相反方向進攻而發生。注意其他三個鍵都指向遠離溴的方向,並指向進攻的親核試劑。當這三個鍵是氫鍵時,接近的親核試劑幾乎沒有空間位阻。然而,隨著R基團數量的增加,空間位阻也隨之增加,使親核試劑更難接近α-碳,以排出溴原子。事實上,叔碳(R3CX)的空間位阻如此之大,以至於完全阻止了SN2機理的發生。
在這個例子中,一個仲α-碳,仍然存在很大的空間位阻,SN2機理是否會發生完全取決於親核試劑和溶劑是什麼。SN2反應優先發生在甲基鹵化物和伯鹵化物中。
另一個需要牢記的重要點是,這在上面的例子中可以清楚地看到,在SN2反應過程中,分子會發生翻轉。當親核試劑接近時,與α-碳相連的鍵會被推開。在過渡態期間,這些鍵與碳共平面,並且隨著溴的離開和親核試劑與α-碳鍵合,其他鍵會從親核試劑處摺疊回來。這在手性或前手性分子中尤為重要,其中R構型將被轉換為S構型,反之亦然。正如你將在下面看到的那樣,這與SN1反應的結果形成對比。
例子
- OH- + CH3—Cl → HO—CH3 + Cl-
OH-是親核試劑,Cl是親電試劑,HOCH3是產物,Cl-是離去基團。
或者,
- Na+I- + CH3-Br → I-CH3 + Na+Br-
上述反應在丙酮作為溶劑的情況下發生,鈉和碘在丙酮中幾乎完全解離,留下碘離子可以自由地攻擊CH-Br分子。帶負電荷的碘離子(親核試劑)攻擊溴甲烷分子,迫使帶負電荷的溴離子離開並取而代之。溴離子是離去基團。
親核性是親核試劑在反應中取代離去基團的速率。通常,親核試劑越大、越極化、越不穩定,其親核性越強。沒有使用特定的數字或計量單位。在其他條件相同的情況下,通常根據相對反應活性來比較親核試劑。例如,一個特定的強親核試劑的相對反應活性可能是一個特定弱親核試劑的10,000倍。這些關係是概括性的,因為溶劑和底物等因素會影響相對速率,但它們通常是哪些物質成為最佳親核試劑的良好指南。
所有親核試劑都是路易斯鹼。在SN2反應中,首選的親核試劑是強親核試劑,同時也是弱鹼。例如N3-、RS-、I-、Br-和CN-。
另一方面,強親核試劑同時也是強鹼也可以起作用。然而,正如文字前面提到的,反應機理有時會相互競爭,對於強親核試劑同時也是強鹼的情況,SN2機理會與E2機理競爭。強親核試劑同時也是強鹼的例子包括RO-和OH-。
親核性下降列表I- > Br- > Cl- >> F- > -SeH > -OH > H2O |
離去基團是底物上離開的基團。在烷基滷代物的情況下,這是當親核試劑進攻時離開碳原子的滷離子。親核試劑離開的趨勢是
離去基團的相對反應活性I- > Br- > Cl- >> F- |
氟離子是非常差的離去基團,因為它們與碳原子結合得很牢固,很少用於烷基滷代物取代反應。離去基團的反應活性與其鹼性有關,鹼性越強,離去基團越差。
溶劑在SN2反應中起著重要作用,特別是在涉及仲烷基滷代物底物的SN2反應中,溶劑可以成為決定反應機理的因素。溶劑還可以極大地影響SN2反應的反應速率。
當溶劑是無質子、極性溶劑時,SN2機理是首選。也就是說,溶劑是極性的,但不含極性氫。極性質子溶劑包括水、醇,以及通常具有極性NH或OH鍵的溶劑。良好的無質子極性溶劑包括HMPA、CH3CN、DMSO和DMF.
首選極性溶劑,因為它能更好地使鹵化物從烷基中解離。然而,具有極性氫的質子溶劑會在親核試劑周圍形成一個由氫鍵連線的溶劑“籠”,阻礙它接近底物。
溶劑的相對反應活性HMPA > CH3CN > DMF > DMSO >> H2O |
SN1機理與SN2機理有很大不同。在某些方面,它正好相反,並且在某些情況下,反應的結果可能會有很大差異。
與SN2 機制類似,結構在SN1 機制中起著重要作用。然而,結構在SN1 機制中的作用截然不同,因此結構的反應性或多或少是相反的。
SN1 的結構反應性CH3X < RCH2X << R2CHX < R3CX |
SN1 機制更適合叔滷代烷烴,並且根據溶劑的不同,可能更適合仲滷代烷烴。SN1 機制不適用於伯滷代烷烴或甲基滷代烷烴。要理解其中的原因,讓我們看看SN1 機制是如何運作的。

在圖的頂部,第一步是鹵化物從滷代烷烴中自發解離。與SN2 機制不同的是,SN2 機制中進攻的親核試劑導致鹵化物離去,而SN1 機制則依賴於鹵化物自身離去的能力。這需要一定的條件。特別是,碳正離子 的穩定性對於鹵化物離去的能力至關重要。由於我們知道叔碳正離子是最穩定的,因此它們是SN1 機制最好的候選者。在適當的條件下,仲碳正離子也會透過SN1 機制進行反應。然而,伯碳正離子和甲基碳正離子不夠穩定,無法使這種機制發生。
一旦鹵化物解離,水就會充當親核試劑與碳正離子鍵合。在SN2 反應中,由於親核試劑從鹵化物仍然與碳鍵合的相反一側進攻,因此會發生反轉。在SN1 機制中,由於鹵化物已經離去,並且α-碳上的鍵已變成平面,因此水分子可以從任一側進攻。這主要導致生成外消旋混合物。在最後一步,與水分子鍵合的水分子的一個氫原子被另一個水分子進攻,留下一個醇。
注意:外消旋混合物意味著混合物完全等量,但這種情況在SN1 中很少見。從鹵化物離去一側的相反一側進攻的趨勢略微明顯。這是因為鹵化物離去後,有時離去的鹵化物離離去的一側足夠近,會阻礙親核試劑從那一側接近。
溶劑
[edit | edit source]與SN2 機制類似,SN1 也會受到溶劑的影響。然而,與結構一樣,原因也不同。在SN1 機制中,使用極性、質子溶劑。溶劑的極性與溶劑的介電常數有關,介電常數高的溶液更有利於支援溶液中分離的離子。在SN2 反應中,我們關注的是極性氫原子“籠罩”我們的親核試劑。在SN1 反應中,使用極性質子溶劑時也會發生這種情況,那麼為什麼我們不擔心呢?你必須記住反應的機理。SN1 反應的第一步,更重要的是限速步驟,是透過使鹵化物陰離子離去來生成穩定碳正離子的能力。對於極性質子溶劑,與極性非質子溶劑一樣,我們正在生成穩定的陽離子,但是是極性氫原子穩定了鹵化物陰離子,使其更容易離去。改善限速步驟始終是目標。親核試劑的“籠罩”與限速步驟無關,即使處於“籠罩”狀態,第二步,親核試劑的進攻,比第一步快得多,以至於可以忽略“籠罩”。
總結
[edit | edit source]SN1、SN2、E1 和 E2 都是反應機理,而不是反應本身。它們是許多不同反應使用的機理。在有機化學中,目標通常是合成產物。在可能存在競爭機理的情況下,特別是SN1 和 E1 反應競爭的情況下,主要的機理將決定你的產物是什麼,因此瞭解機理以及哪些條件有利於一個機理而不是另一個機理,將決定你的產物。
在其他情況下,瞭解機理可以讓你建立有利於該機理的環境。這可能意味著你的產物在幾分鐘內產生,或者在下一個冰河時代產生。
因此,當你設計一個產物的合成方法時,你需要考慮,我想得到產物 Y,那麼我有哪些方法可以得到 Y?一旦你瞭解了你的選擇,並且你決定了反應,那麼你需要考慮反應的機理,並問問自己,如何創造條件使反應正確快速地發生?
消除反應
[edit | edit source]親核取代反應和消除反應有很多共同的特徵,除此之外,E1 和 SN1 以及 E2 和 SN2 反應有時會競爭,由於它們的產物不同,因此理解它們兩者都很重要。如果不理解這兩種機理,就很難從反應中得到你想要的產物。
此外,SN1 和 SN2 反應將在比較和對比中被多次引用,因此最好先閱讀該部分,然後繼續閱讀。
消除反應是將 滷代烷 反應物生成烯烴產物的機理。E1 和 E2 消除反應與 SN1 和 SN2 取代反應不同,它們不會發生在甲基滷代烷烴上,因為反應會在兩個碳原子之間形成雙鍵,而甲基滷代烷烴只有一個碳原子。
注意在符號 E1 和 E2 中,
|
E1 與 E2
[edit | edit source]反應速率
[edit | edit source]E1 和 E2 是兩種從滷代烷烴生成烯烴的不同途徑。與 SN1 和 SN2 反應一樣,主要區別之一在於反應速率,因為它提供了對機理的深刻見解。
E1 反應,與 SN1 反應一樣,是兩步反應。同樣與 SN1 反應一樣,限速步驟是鹵化物從烷烴中解離,使其成為一級反應,取決於滷代烷烴的濃度,反應速率為
另一方面,E2 反應,與 SN2 反應一樣,是一步反應。同樣,與 SN2 反應一樣,限速步驟是親核試劑附著在烷烴上並置換鹵化物的能力。因此它是一個二級反應,取決於親核試劑和滷代烷烴的濃度,反應速率為
- (其中Nu:是進攻的親核試劑)
扎伊採夫規則
[edit | edit source]扎伊採夫規則(有時拼寫為“Saytzeff”)指出,在消除反應中,當多個產物可能存在時,最穩定的烯烴是主要產物。也就是說,取代度最高的烯烴(具有最多非氫取代基的烯烴)是主要產物。
E1 和 E2 反應都會產生混合產物(如果可能的話),但通常遵循扎伊採夫規則。我們將看到,E1 反應更可靠地遵循扎伊採夫規則,並且往往會產生更純的產物。

上圖表示了(S)-2-溴-3-甲基丁烷脫鹵化氫的兩種可能的途徑。兩種潛在的產物是2-甲基丁-2-烯和3-甲基丁-1-烯。右側的影像是對中心影像中顯示的分子產物的簡化繪圖。
如左圖所示,溴原子位於第二個碳原子上。在 **E1** 或 **E2** 反應中,氫原子可以從第一個或第三個碳原子上脫落。扎伊採夫規則指出,氫原子主要從第三個碳原子上脫落。實際上,會得到混合物,但大部分產物將透過 **E1** 機制得到 2-甲基丁-2-烯。透過 **E2** 反應,正如我們稍後將看到的,情況可能並非如此。
E2 結構對反應性的影響RCH2X > R2CHX >> R3CX |
**E2** 機制是一個協同且高度立體專一的反應,因為只有當 H 和離去基團 X 處於反式共平面位置時,該反應才能發生。也就是說,在紐曼投影中,H 和 X 必須相隔 180°,或處於反式構型。這種現象源於當形成 π 鍵時,相鄰碳原子的 2 *p* 軌道之間的最佳重疊。如果由於分子的結構,H 和離去基團無法處於這種位置,則 **E2** 機制將不會發生。

因此,只有具有可達到的 H-X 反式共平面構象的分子才能透過這條途徑發生反應。此外,如果離去基團的唯一反式共平面氫原子導致生成最不穩定的烯烴,則 **E2** 機制將違反扎伊採夫規則。一個很好的例子是觀察環己烷和環己烯衍生物如何在 **E2** 條件下發生反應。

讓我們看一下上面的例子。我們使用的反應物是 1-氯-2-異丙基環己烷。左上角的圖是其中一種構象,下面的圖是在環翻轉之後的構象。中間是兩種構象的紐曼投影,右邊是產物。
如果我們假設用強鹼,例如 CH3CH2O-(乙醇鹽)處理 1-氯-2-異丙基環己烷,那麼主要的反應機制是 **E2**。在氯原子相鄰的碳原子上,有 3 個氫原子。紅色和綠色的是其中兩個。第三個很難顯示出來,但它與紅色氫原子連線在同一個碳原子上,從平面稍微向下傾斜,朝向觀察者。紅色氫原子是唯一與氯原子相隔 180° 的氫原子,因此它是唯一符合 **E2** 機制的氫原子。因此,產物將只有 3-異丙基環己-1-烯。注意,這與扎伊採夫規則相反,扎伊採夫規則指出,取代程度最高的烯烴是優先的。根據他的規則,1-異丙基環己烯應該是我們的主要產物,因為這樣會留下取代程度最高的烯烴。然而,由於空間位阻,它根本無法生成。
下面的影像顯示了環翻轉後的分子。在這種構象中,無法生成產物。從紐曼投影中可以看出,沒有氫原子與氯原子相隔 180°。
因此,在考慮 **E2** 機制時,理解分子的幾何形狀很重要。有時,幾何形狀可以用來幫助優先得到單一產物。其他時候,它會阻止你得到你想要的產物,你需要考慮另一種機制來獲得你的產物。
注意:通常用 **近平面** 一詞代替 **共平面**。**共平面** 意味著精確的 180 度分離,而 “peri-” 來自希臘語,意思是 “附近”,意味著接近 180 度。近平面實際上可能更準確。在 1-氯-3-異丙基環己烷的例子中,由於分子力的作用,氯原子實際上與氫原子和異丙基都略小於 180 度,所以在這種情況下,**近平面** 可能是更準確的術語。

**E1** 機制從離去基團從烷基上解離開始,在烷基上產生一個碳正離子,並留下一個陰離子。這與 **SN1** 反應開始的方式相同,因此有利於 **SN1** 反應中幫助啟動該步驟的因素,也有利於 **E1** 反應中啟動該步驟的因素。更具體地說,二級和三級碳正離子是首選,因為它們比一級碳正離子更穩定。溶劑的選擇與 **SN1** 相同;首選極性質子溶劑,因為極性方面穩定碳正離子,質子方面穩定陰離子。
那麼,決定反應是走 **SN1** 途徑還是 **E1** 途徑的差異,必須取決於第二步;親核試劑的作用。在 **SN1** 反應中,首選強親核試劑,它也是弱鹼。然後,親核試劑會進攻並與碳正離子鍵合。在 **E1** 反應中,仍然首選強親核試劑。不同的是,強親核試劑,也是強鹼,會導致親核試劑攻擊 β-碳上的氫原子,而不是 α-碳正離子。然後,親核試劑/鹼會奪取氫原子,使鍵合電子落入並與碳正離子形成 π 鍵。
由於氫原子和離去基團在兩個獨立的步驟中丟失,並且對幾何形狀沒有要求,因此 **E1** 機制更可靠地產生符合扎伊採夫規則的產物。


![{\displaystyle Rate=k[RX]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/324f51c64b519398368c73c66efe9b5d53d44598)
![{\displaystyle Rate=k[Nu:][RX]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7a9af6c4ef48c9f511b28f0e657d92661dd388f5)