結構生物化學/酶/可逆抑制劑
酶抑制劑是與酶結合並導致其活性降低的分子或化合物。抑制劑可以與酶結合並阻止底物進入酶的活性位點,或防止酶催化化學反應。抑制劑有兩類。
- 不可逆抑制劑
- 可逆抑制劑
抑制劑也可能自然存在,並可能參與代謝調節。例如,抑制劑引起的負反饋有助於維持細胞內的穩態。其他細胞酶抑制劑包括專門與酶靶標結合並抑制其活性的蛋白質。這對於消除有害酶(如蛋白酶和核酸酶)很有用。
酶抑制劑的例子包括毒物和許多不同型別的藥物。
可逆抑制劑可以透過弱的非共價相互作用(如離子鍵、疏水相互作用和氫鍵)與酶結合。由於可逆抑制劑不與酶形成任何化學鍵或反應,因此它們形成速度快,並且可以很容易地去除;因此,與不可逆抑制相比,酶-抑制劑複合物快速解離。
可逆抑制的例子
不可逆抑制的例子
- 基團特異性:僅與特定化學基團反應。
- 反應性底物類似物(親和標記):結構與底物類似的抑制劑,並與活性位點結合。
- 基於機制的抑制劑(自殺抑制劑):酶在活性位點將抑制劑轉化為反應性形式。
可以透過增加底物濃度來克服競爭性抑制,而無法克服非競爭性和非競爭性抑制。
不可逆抑制劑共價結合到酶上,引起酶活性位點的化學變化,並且不可逆轉。不可逆抑制劑的主要作用包括修飾酶活性所需的關鍵氨基酸殘基。它們通常含有反應性官能團,如醛、烯烴或苯磺酸酯。這些親電基團能夠與氨基酸側鏈反應形成共價加合物。氨基酸成分是含有親核側鏈(如羥基或巰基)的殘基,如絲氨酸、半胱氨酸、蘇氨酸或酪氨酸等氨基酸。
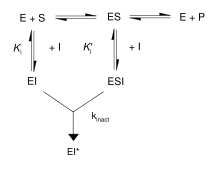
首先,不可逆抑制劑與酶形成可逆的非共價複合物(EI 或 ESI)。然後,該複合物反應生成共價修飾的不可逆複合物 EI*。EI* 形成的速率稱為失活速率或 kinact。可以透過底物或第二個可逆抑制劑的競爭來阻止不可逆抑制劑的結合,因為 EI 的形成可能與 ES 競爭。
此外,一些可逆抑制劑可以透過與它們的靶酶緊密結合來形成不可逆產物。這些緊密結合的抑制劑表現出類似於共價不可逆抑制劑的動力學。如圖所示,這些抑制劑以低親和力的 EI 複合物快速與酶結合,然後經歷緩慢的重排以形成非常緊密結合的 EI* 複合物。這種動力學行為稱為慢結合。慢結合通常涉及酶“合攏”以包圍抑制劑分子的構象變化。這些慢結合抑制劑的一些例子包括重要的藥物,如甲氨蝶呤和別嘌呤醇。
可逆抑制劑非共價結合到酶上,並且可以發生許多不同型別的抑制,具體取決於抑制劑結合的位置。抑制劑與酶之間的非共價相互作用包括氫鍵、疏水相互作用和離子鍵。許多這些弱鍵結合在一起產生強而特異的結合。與底物和不可逆抑制劑相比,可逆抑制劑在結合到酶上時通常不會發生化學反應,並且可以透過稀釋或透析輕鬆去除。
可逆抑制劑有三種類型:競爭性、非競爭性/混合性和非競爭性抑制劑。
- 競爭性抑制劑,顧名思義,與底物競爭同時與酶結合。抑制劑對酶的活性位點具有親和力,底物也在該位點結合。可以透過增加底物濃度來克服這種抑制,從而勝過抑制劑。競爭性抑制劑在結構上通常與真正的底物相似。
- 非競爭性抑制劑與酶的底物同時與酶結合。但是,抑制劑的結合會影響底物的結合,反之亦然。這種抑制無法克服,但可以透過增加底物濃度來減少。抑制劑通常遵循變構效應,即它與酶上不同於底物的位點結合。這種與變構位點的結合改變了酶的構象,從而降低了底物對活性位點的親和力。
- 非競爭性抑制劑結合到其他位點(變構位點),而不是活性位點,並透過改變活性位點的形狀來阻止酶的活性(由破壞保持酶分子在其 3D 形狀中的正常氫鍵和弱疏水相互作用的排列引起的。這種扭曲會傳遞到活性位點,使其不合適)。因此,與競爭性抑制不同,底物濃度毫無意義。
一些可逆抑制劑的例子:
乙醯膽鹼酯酶抑制劑:通常縮寫為 AChEI 或抗膽鹼酯酶,它是一種化學物質,抑制乙醯膽鹼酯酶分解乙醯膽鹼。這最終會導致神經遞質乙醯膽鹼的水平和作用時間增加。
單胺氧化酶 A (maoA) 的可逆抑制劑:maoA 抑制劑包括廣泛的天然藥物和精神藥物,它們暫時且可逆地抑制單胺氧化酶。maoA 抑制劑最常用於對抗抑鬱症和輕度抑鬱症。

大多數可逆抑制劑遵循經典的米氏方程,其中酶 (E) 與其底物 (S) 結合形成酶-底物複合物 (ES)。km 是米氏常數,對應於速度為最大速度一半時的底物濃度。Vmax 是酶的最大速度。
- 競爭性抑制劑只能與 E 結合,而不能與 ES 結合。它們透過干擾底物的結合來增加 Km,但它們不影響 Vmax,因為抑制劑不會改變 ES 中的催化作用,因為它無法與 ES 結合。

-
顯示競爭性抑制的圖
-
競爭性抑制也可以是變構的,只要抑制劑和底物不能同時與酶結合
-
變構競爭性抑制的另一種可能機制
- 非競爭性抑制劑只能與 ES 複合物結合。因此,這些抑制劑由於結合效率提高而降低了 Km,並且由於它們會干擾底物結合並阻礙 ES 複合物中的催化作用而降低了 Vmax。

- 混合抑制劑可以與 E 或 ES 複合物結合,但對其中一個有偏好。這可以分別增加或減少 Km。兩者都會導致 Vmax 降低。
- 非競爭性抑制劑對 E 和 ES 的親和力相同。它們不會改變 Km,但會降低 Vmax。


-
非競爭性或混合抑制可能機制的說明




