結構生物化學/蛋白質/蛋白質
蛋白質是重要的有機化合物,作為結構元素、運輸通道、訊號受體和傳遞者以及催化劑;它們是生物體中用途最廣泛的大分子。蛋白質的組成是由一個或多個多肽組成,這些多肽由 20 種不同的氨基酸亞基組合而成。這些多肽是氨基酸的線性聚合物鏈,透過肽鍵連線在一起,肽鍵是在相鄰氨基酸殘基的羧基和氨基之間形成的。每個氨基酸都有自己的大小、形狀和一組性質,蛋白質有 50 到 2000 個氨基酸以許多不同的組合連線在一起(生命的結構 3)。由於蛋白質可以有許多不同的結構和形狀,因此它們在體內可以具有不同的功能和作用。蛋白質的一個特殊特徵是,只有氨基酸的 L 型異構體存在於自然界中並被用在蛋白質中。目前沒有證據解釋為什麼會這樣。蛋白質上有許多不同的活性官能團附著在上面,以幫助定義它們的性質和功能。蛋白質執行許多重要的功能,從作為非常堅硬的結構元素到在細胞之間傳遞資訊。此外,由於蛋白質彼此之間以及與其他大分子相互作用,形成了複雜的組裝體。蛋白質根據官能團之間的分子內鍵合折疊成二級、三級和四級結構,並根據氨基酸序列呈現各種三維形狀。
例如,膠原蛋白是一種纖維狀結構蛋白,是動物體內含量最豐富的蛋白質。膠原蛋白的結構由三螺旋組成,主要由三個多肽鏈組成,這些鏈透過氫鍵結合在一起,類似於 DNA 的雙螺旋。膠原蛋白的這種結構是透過 X 射線晶體學方法確定的。蛋白質能夠執行各種重要功能,這得益於幾個重要的性質。
1. 線性聚合物:蛋白質由單體單元(氨基酸)構成:根據氨基酸的順序,蛋白質自發地摺疊成三維結構。
2. 包含廣泛的官能團:蛋白質包含官能團,如醇、硫醇、硫醚、羧酸等。這些官能團是蛋白質可以執行的各種功能的關鍵。
3. 蛋白質相互作用以形成複雜的組裝體:在複雜的組裝體中,蛋白質協同作用以實現特定功能。
4. 結構:蛋白質的柔韌性不同。蛋白質的剛性單元可以充當細胞骨架或結締組織中的結構元素。蛋白質結構分為四類,是蛋白質功能特異性的重要因素。
蛋白質通常以 3D 結構顯示。它們通常分為 4 種不同的特徵和級別

一級:多肽的一級結構是指它的氨基酸順序,從頭到尾。多肽的一級結構由編碼基因決定。基因攜帶製造具有特定氨基酸順序的多肽的資訊。一個平均的多肽長度約為 300 個氨基酸,有些基因編碼的多肽長度為數千個氨基酸。
二級:多肽的氨基酸順序以及化學和物理定律導致多肽摺疊成更緊湊的結構。氨基酸可以在蛋白質內的鍵周圍旋轉。這就是蛋白質具有柔韌性並可以摺疊成多種形狀的原因。摺疊可以是不規則的,或者某些區域可以呈現重複的摺疊模式。這種重複模式稱為二級結構。兩種型別是 α-螺旋和 β-摺疊。在 α-螺旋中,多肽主鍊形成一個重複的螺旋結構,該結構透過氫鍵穩定。這些氫鍵以規律的間隔發生,導致多肽主鍊形成螺旋。在 β-摺疊中,多肽主鏈的區域彼此平行。當這些區域形成氫鍵時,多肽主鍊形成一個重複的鋸齒形,稱為 β-摺疊。
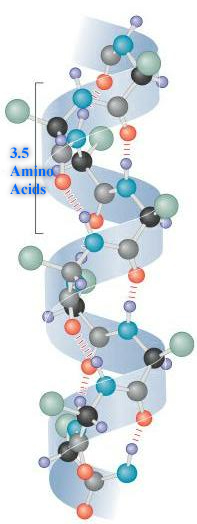
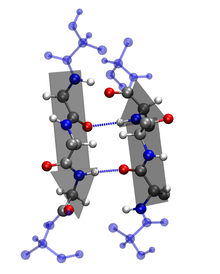
三級:由於一級結構導致二級結構的建立,多肽會摺疊並重新摺疊自身,以呈現一種複雜的三維形狀,稱為蛋白質三級結構。三級結構是單個多肽的三維形狀。對於某些蛋白質,如核糖核酸酶,三級結構是功能蛋白的最終結構。其他蛋白質由兩個或多個多肽組成,並形成四級結構。
四級:大多數功能蛋白由兩個或多個多肽組成,每個多肽都形成三級結構,然後彼此組裝。單個多肽稱為蛋白質亞基。亞基可以是相同的多肽,也可以是不同的多肽。當蛋白質由不止一條多肽鏈組成時,它們被稱為具有四級結構,也稱為多聚體蛋白,意味著有多個部分。這些蛋白質透過氫鍵、鹽橋和二硫鍵等相互作用以特定的形狀結合在一起。蛋白質的兩個主要結構類別是纖維狀和球狀。角蛋白是一種纖維狀蛋白,它存在於羊毛、頭髮、肌肉中的肌球蛋白和肌動蛋白、毛皮、指甲和用於血液凝固的纖維蛋白原中。球狀蛋白的例子包括胰島素、血紅蛋白和大多數酶。

幾個因素決定了多肽形成二級、三級和四級結構的方式。多肽的氨基酸序列是區分一種蛋白質與另一種蛋白質結構的決定性特徵。當多肽在細胞中合成時,它們會摺疊成二級和三級結構,對於大多數蛋白質,這些結構會組裝成四級結構。如前所述,化學和物理定律以及氨基酸序列共同控制著這一過程。五個因素對於蛋白質摺疊和穩定性至關重要
1. 氫鍵
2. 離子鍵和其他極性相互作用
3. 疏水相互作用
4. 範德華力
5. 二硫鍵
蛋白質的功能,如分子識別和催化,取決於它們互補的結合位點。它們還取決於蛋白質三級結構產生的特殊微環境。這種結合位點的特殊微環境最終有助於催化。結合位點具有不同的電荷分佈,允許底物結合。

新增熱量後,蛋白質開始變性。變性發生在三級和二級結構中。如果發生變性,這會導致蛋白質失活,甚至導致細胞死亡並失去功能。
熱量能夠使蛋白質變性的原因是它會破壞鍵,因為它會導致這些分子快速振動。
熱量會影響三級和二級結構。蛋白質的一級結構只是肽鍵,熱量不足以破壞這些肽鍵,因此熱量不會影響一級結構。
肥胖症患者表現出暴食以及胰島素和瘦素水平升高,儘管瘦素應該是一種抑制進食的物質,同時降低胰島素水平並抑制胰島素的產生。由於暴食可能會導致瘦素抵抗,瘦素可能無法像預測的那樣發揮作用。這可能也與胰島素抵抗有關。瘦素是生化途徑和代謝通量的強效調節劑,進而導致葡萄糖通量的重新分佈。研究表明,早期由於過度進食而分泌的瘦素可能與肥胖和葡萄糖耐受不良有關。過度進食會降低維持正常血糖水平所需的葡萄糖輸注率。因此,碳水化合物的攝入量發生了巨大變化,因為在過度進食 7 天后,葡萄糖攝入率降低了。過度進食顯著降低了胰島素對葡萄糖生成的抑制作用。自願過度進食降低了瘦素對食物消耗的影響程度。在一個用過度餵食的大鼠和對照組大鼠進行的實驗中,透過向兩組注射瘦素證明了這一點。過度餵食的大鼠組對瘦素沒有反應,因此它們的食量沒有減少,但對照組則出現了瘦素的預期結果。在對照組中,瘦素按預期發揮作用,抑制了食物攝入。由於食物攝入量增加導致的體重增加可能與胰島素抵抗以及暴食期間葡萄糖生成早期增加有關。因此,證明了食物消耗量的增加在瘦素系統癱瘓/下降以及胰島素對碳水化合物代謝作用下降中發揮作用。
Matthew D. Shoulders 和 Ronald T. Raines. "膠原蛋白結構和穩定性" http://www.annualreviews.org/doi/full/10.1146/annurev.biochem.77.032207.120833?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%3dpubmed "四級蛋白。"埃爾姆赫斯特學院:伊利諾伊州埃爾姆赫斯特。網路。2011 年 11 月 12 日。<http://www.elmhurst.edu/~chm/vchembook/567quatprotein.html>。 http://diabetes.diabetesjournals.org/content/50/12/2786.full.pdf+html
