結構生物化學/蛋白質/純化/等電聚焦
等電點,也稱為蛋白質的pI,是指蛋白質淨電荷為零時的pH值。等電聚焦是一種分離技術,根據蛋白質的等電點(或其殘基的酸鹼度)分離肽。帶有pH梯度的凝膠被用作介質。pH梯度透過將具有不同pI的多電荷聚合物(即兩性電解質)新增到凝膠中來形成。然後將樣品置於凝膠上並施加電壓。蛋白質將沿著凝膠移動,直到它們達到它們的等電點。換句話說,每種蛋白質都會移動直到它到達凝膠中pH值等於蛋白質pI的位置。然後可以去除在給定pH值下形成的蛋白質帶並進一步分析。該過程可以成功地分離淨電荷差大於或等於1的蛋白質。
等電點(pI):蛋白質淨電荷為零時的pH值。對於具有許多鹼性氨基酸的蛋白質,pI將較高,而對於酸性蛋白質,pI將較低。
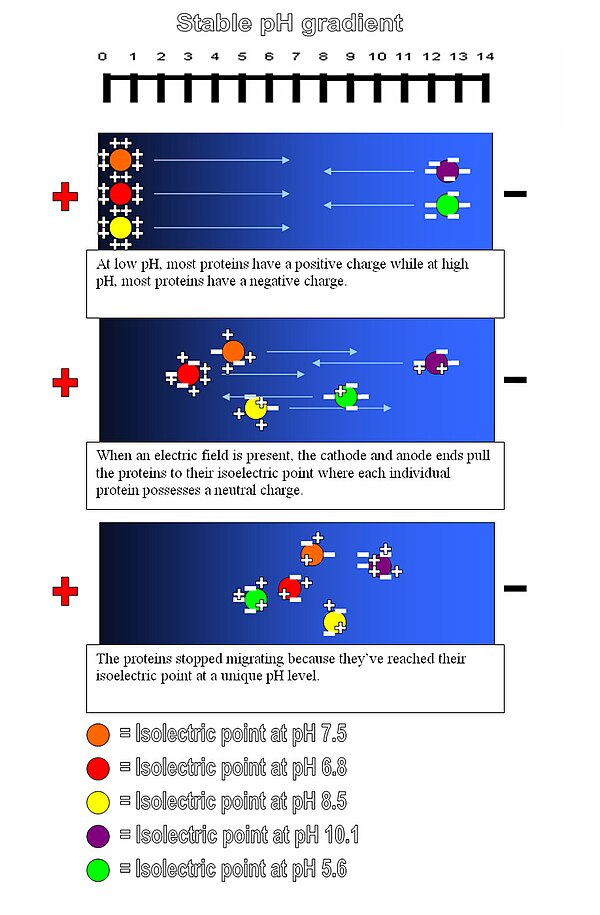
等電聚焦是一種區域電泳,通常在凝膠中進行,它利用了這樣一個事實,即分子的電荷會隨著其周圍環境的pH值而變化。在低於其等電點(pI)的pH區域中的蛋白質將帶正電荷,因此將遷移到陰極。然而,隨著它遷移,電荷會減少,直到蛋白質到達與其pI對應的pH區域。此時它沒有淨電荷,因此遷移停止。結果,蛋白質被聚焦成尖銳的靜止帶,每種蛋白質位於與其實際pI對應的pH梯度中的一個點。該技術能夠實現極高的解析度,即使差異僅為一個電荷的蛋白質也能被分餾成單獨的帶。
要聚焦的分子分佈在具有pH梯度的介質上(通常由脂肪族兩性電解質產生)。電流透過介質,產生“正”陽極和“負”陰極端。帶負電荷的分子透過介質中的pH梯度遷移到“正”端,而帶正電荷的分子遷移到“負”端。當一個粒子向與其電荷相反的極移動時,它會穿過不斷變化的pH梯度,直到它到達一個點,在那裡達到該分子的等電點的pH值。此時,分子不再具有淨電荷(由於相關官能團的質子化或去質子化),因此不會在凝膠中繼續移動。在新增目標粒子之前,首先透過對含有不同pI值的少量分子(如兩性電解質)的溶液進行電泳來建立梯度。
該方法應用於蛋白質研究,蛋白質根據其酸性和鹼性殘基的相對含量進行分離,其值由pI表示。將蛋白質引入到由聚丙烯醯胺、澱粉或瓊脂糖組成的固定pH梯度凝膠中,其中已建立了pH梯度。等電聚焦可以解析pI值相差僅0.01的蛋白質。等電聚焦是二維凝膠電泳的第一步,其中蛋白質首先根據其pI進行分離,然後透過SDS-PAGE進一步根據分子量進行分離。
當我們知道其pKa值時,我們可以透過用NaOH滴定來確定每個氨基酸的pI。例如,最小的氨基酸甘氨酸有兩個pKa值,分別為2.34和9.60。[1]
首先,加入強酸並使甘氨酸完全質子化。然後逐漸加入NaOH,直到pH升至2.34。此時,我們使用0.5摩爾的NaOH相當於甘氨酸的第一個質子化形式。此外,溶液中會生成0.5摩爾的第二質子化形式。在使用1摩爾的NaOH相當於第一個質子化形式後,將只剩下第二質子化形式。我們將看到甘氨酸的第二質子化形式是兩性離子,它是淨電荷為零的分子。因此,此時pH被稱為等電點(pI),等於5.97。繼續加入NaOH,直到pH等於9.60。此時,溶液中存在0.5摩爾的第三質子化形式,NaOH的總量為1.5摩爾。回到pI,我們看到
然後我們可以寫成一般形式
備註 要確定具有兩個以上pKa值的氨基酸的pI,我們將使用覆蓋兩性離子存在於溶液中的範圍內的兩個pKa值。[2]