AP 化學/基礎
你應該記得高中化學課上的所有內容。
- AP 考試中不使用華氏度。使用攝氏度 (°C) 和開爾文 (K)。純水在 0° 攝氏度 (273K) 結冰,在 100° 攝氏度 (373K) 沸騰。在 AP 考試中,開爾文可以透過新增 273.15 轉換為攝氏度。
有效數字用於確保正確傳達精度。當給出測量值時,最後一個數字被認為是 ±1。例如,數字 3.5 被認為在 3.4 到 3.6 之間,當沒有給出精確精度時。
- 數字 1 到 9 是有效的,介於它們之間的零也是有效的。例如,數字 209 有三個有效數字。
- 所有其他數字右邊的零隻有在寫有小數點時才有效。290 有 2 個有效數字,290. 有三個,290.0 有四個。
- 前導零無效。0.00209 只有三個有效數字。
精確值是定義值或計數結果。一打定義為 12 個物體。一磅定義為 16 盎司。精確值被認為具有無限個有效數字。相反,測量值總是像前面描述的那樣具有有限個有效數字。報告為 12 克的質量意味著已知到最接近的克,而不是到十分之一克。
12 克碳-12 恰好包含一摩爾 (6.02×1023) 個分子。這是一個被稱為阿伏伽德羅常數的測量值。使用阿伏伽德羅常數可以輕鬆地在原子質量、克和粒子之間轉換。
在化學中,乘以測量值不像在數學中那樣乘以。在數學課上,5 * 92 等於 460,但在化學中等於 500。這是因為 5 只有一個有效數字,所以答案必須四捨五入到一個有效數字。另一方面,如果乘以 5.0 和 92,則答案在兩個學科中都是 460。
- 首先,將所有數字垂直對齊,就像你要加它們一樣。不要寫任何額外的零作為佔位符。
- 新增
- 四捨五入到每個數字中包含數字的最小的位數。
例如:210 + 370. + 539
210 370. 539 +---- 1119 ≈ 1120
- 固體 (s) - 具有確定的形狀和體積。在原地振動,但不會流動。
- 流體 - 呈現容器的形狀。
- 液體 (l) - 具有確定的體積
- 氣體 (g) - 可變體積(可壓縮)
- 德謨克利特 - 提出原子概念的哲學家。
- 安託萬·拉瓦錫 - 發現了質量守恆定律,該定律指出質量在化學反應中不會出現或消失,只會重新排列。
- 約翰·道爾頓 - 第一位用科學方法描述原子理論的科學家。
- 物質是由稱為原子的不可破壞的粒子構成的。
- 相同元素的原子是相同的。
- 化合物是由兩個或多個原子結合在一起形成的。
- 化學反應是原子的重新排列。
- J.J. 湯姆遜 - 發現了電子。
- 羅伯特·密立根 - 發現了電子的質量和電荷。
- "葡萄乾布丁模型" - 原子就像布丁一樣,電子像葡萄乾一樣。
- 歐內斯特·盧瑟福 - 透過他的金箔實驗,發現了原子核。由於他射入金箔的大多數α粒子沒有發生偏轉,他得出結論,原子的大部分是空曠的空間。
原子由質子、中子和電子組成。質子和中子的質量約為 1 AMU,而電子的質量可以忽略不計。元素由原子中的質子數決定,稱為原子序數。中子的數量會有所不同,從而產生不同質量的不同同位素。原子的原子質量是其質子和中子的總和,質子和中子都位於原子核中。
電子被排列成圍繞原子核的電子層。每個電子層有 1-4 個亞層,亞層本身有 1-7 個軌道,每個軌道可以容納兩個電子。
| 電子層 | 亞層 | 軌道 |
|---|---|---|
| 1 | s | 1 |
| 2 | s, p | 1 + 3 = 4 |
| 3 | s, p, d | 1 + 3 + 5 = 9 |
| 4 | s, p, d, f | 1 + 3 + 5 + 7 = 16 |
- 泡利不相容原理 - 按照以下影像,首先填充最低能量亞層。
- 例外:鑭系元素和錒系元素中的元素包含細微差別,並不嚴格遵循 gif 模式。這些系列兩側的元素確實遵循 gif。
- 洪特規則 - 在將第二個電子放入這些軌道中的任何一個之前,先在亞層中的每個軌道上填充一個電子。
例如,鈉 = 1s22s22p63s1
價層電子對互斥理論 (VESPR)。化合物中的電子會盡可能地遠離彼此。成鍵電子對比非成鍵電子對的排斥力更強。
電子對分離需要軌道雜化。這些雜化軌道從sp到sp3d2,包含2到6對電子。這導致了分子中每個中心原子的多種形狀。
| ↓有效電子對和雜化 孤對電子→ | 0 | 1 | 2 | 3 |
|---|---|---|---|---|
| 2 sp | 線性 180° | 不適用 | 不適用 | 不適用 |
| 3 sp2 | 平面三角形 120° | 彎曲形 | 不適用 | 不適用 |
| 4 sp3 | 四面體 109.5° | 三角錐形 | 彎曲形 | 不適用 |
| 5 sp3d | 三角雙錐 120° 90° 180° | 蹺蹺板形 | T形 | 線性 |
| 6 sp3d2 | 八面體 90° 180° | 四方錐形 | 平面正方形 | 不適用 |
- σ鍵 - 在所有化合物中形成
- π鍵 - 每個在兩個原子之間共享的額外的電子對形成一個或多個π鍵。這些鍵比σ鍵更弱。

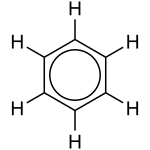
有時,有不止一種“正確”的方法來繪製物質。實際上,物質的結構是繪製變化的平均值。
你應該已經熟悉這個。每一行被稱為週期,每一列被稱為族或族。非金屬和金屬由右側的鋸齒形線隔開。(氫也是非金屬)。位於該線附近的元素被稱為類金屬,它們兼具金屬和非金屬的特性。
氧化數是追蹤電子的一種方法,確保化合物的各個部分以正確的比例匹配。
- 純元素的氧化數為零。
- 單原子或多原子離子,氧化數等於它們的電荷。
- 共價化合物和離子化合物的氧化數之和必須等於零。
- 與其他元素鍵合的1族金屬的氧化數為+1,2族金屬的氧化數為+2,鹵素的氧化數為-1,除非與氧鍵合。
- 與其他元素鍵合的氧的氧化數為-2,除非它在氫氧根(OH)中,此時為-1,或與氟鍵合,此時為正數。
- 與其他元素鍵合的氫的氧化數在與金屬鍵合時為-1,在與非金屬鍵合時為+1。
(第一個元素的名稱) (第二個元素的名稱 + 化物) 例如氯化鈉。
氫(非金屬+酸) 例如氫溴酸 (HBr)
(第一個元素的名稱) (多原子離子的名稱) 例如氫氧化鈉 (NaOH)。請注意,有一個例外 - 銨離子 (NH4+) 可以代替第一個元素。
按以下順序:(氫)(非金屬)(氧)
如果離子以-ate結尾,則酸將命名為(非金屬)酸。例如,H2SO4 包含硫酸根離子。它被稱為硫酸。
如果離子以-ite結尾,則酸將命名為(非金屬)亞酸。
一些元素,特別是過渡金屬,可以有多個氧化數。因此,必須用羅馬數字寫出正氧化數。例如,CuO 是氧化銅 (II),Cu2O 是氧化銅 (I)。

