結構生物化學/核酸/DNA/DNA 結構
脫氧核糖核酸 (DNA) 儲存特定蛋白質合成資訊。DNA 以 脫氧核糖 為其糖。 DNA 由磷酸基團、糖和 含氮鹼基 組成。 DNA 的結構是一種螺旋狀的雙鏈大分子,鹼基突向分子內部。這兩條鏈的序列始終互補。在 DNA 複製(遺傳的主要來源)過程中,一條鏈作為另一條鍊形成的模板。 DNA 的這一獨特特徵為生命連續性提供了一種機制。DNA 的結構是由羅莎琳德·富蘭克林發現的,她使用 X 射線晶體學研究遺傳物質。她獲得的 X 射線照片揭示了 DNA 的物理結構為螺旋。
DNA 具有雙螺旋結構。外邊緣由交替的脫氧核糖糖分子和 磷酸基團 形成,構成糖磷酸骨架。這兩條鏈以相反的方向延伸,一條從 3' 到 5' 方向,另一條從 5' 到 3' 方向。 含氮鹼基 位於螺旋結構內側,就像“梯子的橫檔”一樣,這是由於疏水效應,並由氫鍵穩定。
| 含氮鹼基 | 核苷 | 脫氧核苷 |
|---|---|---|
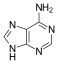 腺嘌呤 |
 腺苷 A |
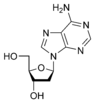 脫氧腺苷 dA |
 鳥嘌呤 |
 鳥苷 G |
 脫氧鳥苷 dG |
 胸腺嘧啶 |
 5-甲基尿苷 m5U |
 脫氧胸腺嘧啶 dT |
 尿嘧啶 |
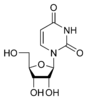 尿苷 U |
 脫氧尿苷 dU |
 胞嘧啶 |
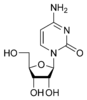 胞苷 C |
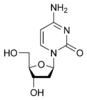 脫氧胞苷 dC |
這兩條鏈以相反的方向延伸形成雙螺旋。這些鏈透過氫鍵和疏水相互作用保持在一起。H 鍵形成於反平行鏈的鹼基對之間。第一條鏈中的鹼基只與第二條鏈中的特定鹼基形成 H 鍵。這兩個鹼基形成一個鹼基對(H 鍵相互作用,使鏈保持在一起並形成雙螺旋結構)。 DNA 中的鹼基對是 腺嘌呤-胸腺嘧啶 (A-T) 和 胞嘧啶-鳥嘌呤 (C-G)。這種相互作用使我們理解,含氮鹼基位於 DNA 雙螺旋結構內部,而糖和磷酸基團位於雙螺旋結構外部。
由鹼基和糖組成的成分稱為核苷。 DNA 包含脫氧腺苷(脫氧核糖與 腺嘌呤 相連)、脫氧鳥苷(脫氧核糖與 鳥嘌呤 相連)、脫氧胞苷(脫氧核糖與 胞嘧啶 相連)和脫氧胸腺嘧啶(脫氧核糖與 胸腺嘧啶 相連)。鹼基與糖之間鍵的連線稱為 β-N-糖苷鍵。在 嘌呤 中,這發生在 N-9 和 C-1' 之間,在 嘧啶 中,這發生在 N-1 和 C-1' 之間。核苷和磷酸基團構成核苷酸。脫氧核糖核苷的脫氧核糖與磷酸基團之間的鍵是 3'-5' 磷酸二酯鍵。
位於雙螺旋內部的鹼基是堆積的。堆積鹼基透過範德華力相互作用。雖然範德華相互作用的能量相對較小,但在螺旋結構中,大量的原子交織在一起進行這種相互作用,能量的淨總和相當大。兩個相鄰鹼基之間垂直於主軸的距離是 3.4 Å。 DNA 結構是重複的。每轉十個鹼基,也就是說結構在 34 Å 後重復,因此每個鹼基的旋轉角度為 36°。雙螺旋的半徑約為 10 Å。
區分核苷和脫氧核苷的簡單方法是糖單元中與 C-2 相連的原子。如果結構是脫氧核苷,則 C-2 帶有兩個氫。如果是核苷,則 C-2 帶有一個氫和一個羥基,其中羥基朝南。
如果發生以下情況,DNA 結構可能會發生變化
1. 存在不同的脫氧核糖構象
2. 如果磷酸脫氧核糖骨架中相鄰鍵之間存在旋轉
3. 圍繞 C-1'N=糖苷鍵的自由旋轉 (syn/anti)[1]
有兩種型別的核酸,核糖核酸 (RNA) 和 脫氧核糖核酸 (DNA)。回想一下,核苷是鹼基 + 糖。核苷酸由鹼基 + 糖 + 磷酸組成。脫氧核苷酸中的“脫氧”字首是用於 DNA 的命名法。當它用於 RNA 的命名法時,採用術語核糖核苷酸,換句話說,糖單元上的 C-2 具有 -OH 基團(與脫氧不同,脫氧的 C-2 具有 2 個氫)。使用符號來簡化名稱。例如,ATP(RNA 的前體)。前面的“A”表示鹼基是 腺嘌呤,“T”表示三磷酸。另一方面,AMP 也具有 腺嘌呤,但 M 表示糖與單個磷酸基團結合。最後,在 dAMP 中,“d”表示它是 2'-脫氧核糖,而僅僅 AMP 表示它是核糖核苷酸。簡而言之,DNA 的四個核苷酸單位稱為脫氧腺苷酸、脫氧鳥苷酸、脫氧胞苷酸和胸腺嘧啶酸。
核酸的一級結構是指其共價結構和核苷酸序列。確定 DNA 結構最重要的部分之一來自埃爾溫·查伽夫及其同事在 20 世紀 40 年代末的研究。他們發現,不同生物體的 DNA 中的四種核苷酸鹼基數量不同,並且某些鹼基的數量密切相關。他們得出以下關於 DNA 結構的結論:

1. DNA 的鹼基組成通常因物種而異。
2. 從同一物種的不同組織中分離得到的 DNA 樣本具有相同的鹼基組成。
3. 給定物種中 DNA 的鹼基組成不會隨時間、營養狀態或環境而改變。
4. 在所有細胞 DNA 中,無論物種如何,腺嘌呤殘基的數量等於胸腺嘧啶殘基的數量 (A=T),鳥嘌呤殘基的數量等於胞嘧啶殘基的數量 (G=C)。
後來在 1953 年,羅莎琳德·富蘭克林和莫里斯·威爾金斯使用了一種強大的 X 射線衍射技術,稱為 X 射線晶體學,推斷出 DNA 的結構。透過 X 射線晶體學 方法產生的照片實際上不是分子照片,但是 X 射線透過結晶的 DNA 衍射(偏轉)時產生的斑點和汙點。晶體學家使用數學方程式將這些斑點模式轉換為有關 DNA 三維形狀的資訊。富蘭克林和威爾金斯發現,DNA 分子是螺旋形的,沿其長軸有兩個週期性,一個主要的週期為 3.4 埃,另一個次要的週期為 34 埃。

沃森和克里克後來根據他們從威爾金斯和富蘭克林的 X 射線衍射照片中提取的資料建立了 DNA 模型。
http://37days.typepad.com/37days/images/2008/03/02/franklin20dna20photo.jpg
他們解釋了 X 射線照片上斑點的模式,這意味著 DNA 由兩條鏈組成,呈螺旋形。最終,沃森和克里克根據 X 射線照片的衍射模式制定了 DNA 結構,並獲得了今天仍然被接受的令人難以置信的見解。在這個結構中,他們提出兩條方向相反的螺旋狀 DNA 鏈纏繞在同一個軸上,形成右手雙螺旋。親水主鏈由交替的脫氧核糖糖和 磷酸 基團的磷酸二酯鍵形成,這些主鏈位於螺旋外部,被水環境包圍。每個脫氧核糖糖的呋喃糖環處於 C-2' endo 構象。兩條鏈的 嘌呤 和 嘧啶 鹼基堆疊在雙螺旋內部,並透過範德華相互作用穩定。
雙螺旋的直徑為 10 埃。雙螺旋中一條鏈上的每個相鄰鹼基相距 3.4 埃。每 10 個鹼基對構成螺旋的 360 度旋轉,螺旋的長度由每 10 個鹼基對的 34 埃決定。


DNA 分子是不對稱的,這種性質在 DNA 複製 和轉錄過程中至關重要。雙鏈 DNA 分子由兩條互補但分離的鏈組成,透過氫鍵網路相互交織成螺旋狀。雖然右手螺旋和左手螺旋都屬於允許的構象,但右手螺旋在能量上更有利,因為側鏈和主鏈之間的空間位阻更小。DNA 的方向由磷酸基團和脫氧核糖糖基團沿 DNA 主鏈的排列決定。DNA 的一個末端以 3'-OH 基團終止,而另一個末端以 5'-磷酸基團終止。所有 DNA 序列通常從 5' 末端到 3' 末端書寫。在雙螺旋形成中,互補的 DNA 鏈以相反的方向定向。DNA 是一種相當剛性的分子:在生理條件下,DNA 在大約 50 奈米的長度尺度上彎曲,這大約是雙螺旋直徑的 20 倍。更重要的是,鹼基的對齊可以指示 DNA 鏈的全域性方向。對於 嘌呤 核苷酸 (A 和 G),最可能的角度大約為 88 度,而對於 嘧啶 (C 和 T),該角度大約為 105 度。
DNA 雙螺旋透過兩種主要力量保持在一起:螺旋內部互補鹼基對之間的氫鍵以及範德華鹼基堆積相互作用。
沃森和克里克發現,氫鍵連線的鹼基對,G 與 C,A 與 T,是最適合 DNA 結構的鹼基對。需要注意的是,G 和 C 之間可以形成三個氫鍵,但在 A 和 T 對中只能找到兩個鍵。另一方面,A-T 對似乎會使雙螺旋結構不穩定。這一結論得益於一個已知的事實,即在每個物種中,G 的含量等於 C 的含量,T 的含量等於 A 的含量。
以下是鹼基對之間氫鍵的演示連結
http://chemmac1.usc.edu/java/bases/basepairs.html
構成 鳥嘌呤 (G) 和 胞嘧啶 (C) 連線的三個氫鍵因此改變了 DNA 的熱熔解,這取決於鹼基組成。隨著鹼基組成的變化,這種分子的熔點也會升高或降低。
變性和退火
紫外 (UV) 光可以檢測鹼基是堆疊還是非堆疊。DNA 結構 中堆疊的鹼基有利於遮蔽光線,因此雙螺旋 DNA 對紫外光的吸收遠小於單鏈 DNA。這種特性被稱為減色效應,即 DNA 分子雙螺旋發射的顏色更少。
熔點 (Tm) 是 DNA 一半處於雙鏈狀態,一半處於單鏈狀態的溫度。Tm 在很大程度上取決於鹼基組成。由於 G-C 鹼基對由於氫鍵更多而更強,因此 G-C 含量高的 DNA 將具有比 A-T 含量更高的 DNA 更高的 Tm。
當熱量作用於雙鏈DNA時,每條單鏈最終都會分離(變性),因為鹼基對之間的氫鍵被破壞。分離後,分離的鏈會自發地重新結合,再次形成雙螺旋結構。這個過程被稱為退火。
在生物系統中,變性和退火都會發生。解旋酶利用化學能(來自 ATP)破壞雙鏈核酸分子的結構。DNA在實驗室中重新結合的能力研究對於發現基因結構和表達至關重要。
複雜結構
從單鏈DNA中也可以形成複雜結構。當同一鏈內的互補序列配對形成雙螺旋結構時,就會形成莖環結構。同一鏈內的鹼基對之間會形成氫鍵。通常,這些結構包含錯配的鹼基,導致區域性結構的不穩定。這種作用在更高階的摺疊中可能很重要,比如在三級結構中。
DNA在接近紫外光波長(~260 奈米)處強烈吸收。單鏈 DNA 比雙鏈DNA吸收更多的紫外光。DNA在形成雙鏈時,其紫外吸收會降低,這種特性是DNA穩定性的一個指標。隨著光能的增加,其結構及其功能仍然保持完整,因為其結構受到的干擾很小。
觀察到的DNA雙螺旋相對於天然和變性形式的吸光度降低可以用以下事實來解釋:雙螺旋結構中含氮鹼基的堆積不會使它們暴露在輻射中,因此它們能夠吸收的輻射更少。含氮鹼基的芳香性(特別是在嘌呤和嘧啶等環狀結構中)解釋了吸收峰位於 260 奈米的原因。
各種弱力共同作用,穩定DNA結構。
- 氫鍵,鹼基之間的連線,儘管能量上很弱,但由於DNA分子中存在大量的氫鍵,因此能夠穩定螺旋結構。
- 堆積相互作用,也稱為鹼基之間的範德華相互作用,很弱,但大量的這種相互作用有助於穩定螺旋的整體結構。
- 雙螺旋結構透過疏水效應穩定,將鹼基埋在螺旋的內部會增加其穩定性;將疏水性鹼基聚集在螺旋的內部可以防止它們與周圍的水接觸,而更極性的表面,即親水性頭部暴露出來,並與外部水相互作用。
- 堆積的鹼基對也透過範德華力相互吸引,單個範德華相互作用所對應的能量對整體DNA 結構的影響很小,但是,對所有原子對進行求和得到的淨效應會產生顯著的穩定性。
- 堆積也傾向於有利於骨架磷酸-糖的較硬的五元環的構象。
- 電荷-電荷相互作用- 指帶負電荷的磷酸鹽之間的靜電(離子-離子)排斥,這可能是不穩定的,然而,存在 Mg2+ 和富含精氨酸和賴氨酸殘基的陽離子蛋白,它們會穩定雙螺旋結構。
含氮鹼基是DNA聚合物的基礎結構,DNA 聚合物的結構隨連線的不同含氮鹼基而變化。
含氮鹼基可以在酮式和烯醇式之間互變異構。嘧啶(胞嘧啶、胸腺嘧啶、尿嘧啶(RNA))和嘌呤(腺嘌呤、鳥嘌呤)環體系的芳香性和它們富含電子的 -OH 和 -NH2 取代基使它們能夠發生酮-烯醇互變異構。酮式互變異構體稱為內醯胺,烯醇式互變異構體稱為內醯亞胺。在 pH 7 時,內醯胺占主導地位。酮-烯醇互變異構是酮和烯醇之間的相互轉換,涉及質子的移動和成鍵電子的轉移,因此這種異構體屬於互變異構現象。
酮-烯醇互變異構在 DNA 結構中很重要,因為磷酸烯醇丙酮酸的高磷酸轉移勢導致磷酸化合物被困在較不穩定的烯醇式中,而脫磷酸化導致酮式。鹼基鳥嘌呤和胸腺嘧啶的稀有烯醇式互變異構體可能由於鹼基配對特性的改變而導致突變。
雙鏈DNA的兩個鏈透過許多弱相互作用結合在一起,例如氫鍵、堆積相互作用和疏水效應。在這些作用中,鹼基對之間的堆積相互作用是最重要的。鹼基堆積相互作用的強度取決於鹼基。對於 G-C 鹼基對的堆積,強度最強,而對於 A-T 鹼基對的堆積,強度最弱。疏水效應使鹼基彼此堆疊。堆積的鹼基對透過範德華力相互吸引,通常為 2 到 4 kJ/mol-1。此外,DNA中的鹼基堆積有利於骨架磷酸-糖的相對剛性的五元環的構象。鹼基堆積相互作用在很大程度上與堆積的鹼基的同一性無關,對雙螺旋結構的穩定性做出了主要貢獻。
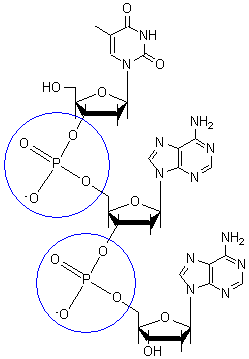
磷酸二酯鍵形成DNA的共價骨架。磷酸二酯鍵是在DNA中脫氧核糖的 3' 碳原子和 5' 碳原子之間形成的連線。
磷酸二酯鍵中的磷酸鹽基團帶負電荷。磷酸鹽基團的 pKa 接近 0,因此它們在中性 pH(pH=7)下帶負電荷。這種電荷-電荷排斥力迫使磷酸鹽基團在DNA鏈的相反位置上,並被蛋白質(組蛋白)、金屬離子(如鎂)和多胺中和。
核苷酸構建塊的三磷酸或二磷酸形式首先必須被分解,以釋放驅動磷酸二酯鍵形成和核苷酸連線的酶促反應所需的能量。一旦單個磷酸或兩個磷酸(焦磷酸鹽)分解並參與催化反應,就會形成磷酸二酯鍵。
磷酸二酯鍵的水解由磷酸二酯酶催化,磷酸二酯酶是一種促進修復的酶,因此在修復DNA序列中發揮著重要作用。
DNA 比 RNA 更穩定的原因之一是 DNA 中沒有 2'-OH 基團。2'C 上存在 OH 基團使 RNA 更容易發生反應。親核試劑(鹼基)可以拉出 H(當所有物質都處於正確的軌跡時),並且骨架的磷酸部分會重新排列,最終 P-O 鍵斷裂,從而斷開兩個糖之間的連線位點。
大溝和小溝
互補核苷酸的鹼基配對構成了DNA的二級結構。單鏈DNA可以參與互補鹼基對之間的分子內鹼基配對,因此也形成二級結構。腺嘌呤 (A)-胸腺嘧啶 (T) 和鳥嘌呤 (G)-胞嘧啶 (C) 之間的鹼基配對是可能的,因為這些鹼基對的大小相似。這意味著雙螺旋結構內沒有“凸起”或“間隙”。
雙螺旋結構中鹼基對的不規則排列會導致大分子失去功能。因此,如果結構出現問題,就會發出訊號,DNA修復機制會修復損傷。
由於DNA的雙螺旋結構,該分子具有兩個不對稱的溝槽。一個溝槽比另一個溝槽小。這種不對稱性是由磷酸基、糖基和鹼基之間鍵的幾何構型造成的,它迫使鹼基以120度角而不是180度角連線。較大的溝槽稱為主溝,發生在骨架相距較遠時;而較小的溝槽稱為次溝,發生在骨架彼此靠近時。
由於主溝和次溝暴露了鹼基的邊緣,因此可以利用這些溝槽來判斷特定DNA分子的鹼基序列。這種識別的可能性至關重要,因為蛋白質必須能夠識別特定的DNA序列,以便在這些序列上結合,以實現身體和細胞的正常功能。正如您所料,主溝比次溝包含更多資訊,允許DNA蛋白與鹼基相互作用。這一事實使得次溝不太適合蛋白質結合。

以下特徵代表了 A 型 DNA 結構的不同特徵
1. 大多數 RNA 和 RNA-DNA 雙鏈以這種形式存在
2. 比 B 型更短、更寬的螺旋。
3· 深而窄的主溝不易被蛋白質訪問
4· 廣泛而淺的次溝可被蛋白質訪問,但資訊量低於主溝。
5· 在低水濃度下有利的構象
6· 鹼基對相對於螺旋軸傾斜,並從軸上移位
7· 糖構象 C3'-endo(在 RNA 中 2'-OH 抑制 C2'-endo 構象)
8· 右旋
9· 尺寸約為 26 埃
10· 每螺旋圈需要 11 個鹼基對
11· 糖苷鍵構象為反式
正常DNA的雙螺旋結構採用右手形式,稱為 B 型螺旋。它約為 20 埃,具有 C-2' endo 糖構象。螺旋大約每 10 個鹼基對旋轉一圈(= 每重複 34 埃 / 每鹼基 3.4 埃)。B 型 DNA 具有兩個主要的溝槽,一個寬的主溝和一個窄的次溝。許多蛋白質在主溝的空間內相互作用,在那裡它們與鹼基形成序列特異性接觸。此外,已知一些蛋白質透過次溝形成接觸。
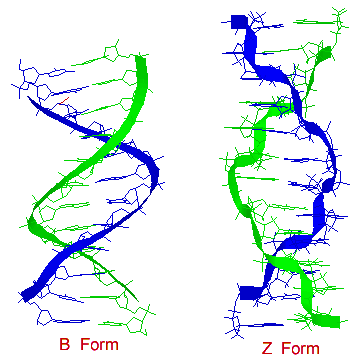
DNA序列可以從 B 型轉變為 Z 型,反之亦然。Z 型DNA與 B 型結構有更根本的差異;最明顯的區別是左手螺旋旋轉。
Z 型約為 18 埃,每螺旋圈有 12 個鹼基對,並且結構看起來更細長。DNA骨架呈現鋸齒狀。某些核苷酸序列比其他序列更容易摺疊成左手 Z 型螺旋。突出的例子是嘧啶與嘌呤交替出現的序列,尤其是交替的 C 和 G 或 5-甲基-C 和 G 殘基。為了在 Z 型 DNA 中形成左手螺旋,嘌呤殘基翻轉到順式構象,與反式構象的嘧啶交替出現。在 Z 型 DNA 中,主溝幾乎看不出來,而次溝則又窄又深。對於嘧啶,糖的構象為 C-2' endo,而對於嘌呤,糖的構象為 C-3' endo。
Z 型DNA的形成發生在基因轉錄過程中,發生在活躍轉錄基因的啟動子附近的轉錄起始位點。在轉錄過程中,RNA 聚合酶的移動在轉錄位點上游誘導負超螺旋,在下游誘導正超螺旋。上游的負超螺旋有利於 Z 型 DNA 的形成;Z 型DNA的功能是吸收負超螺旋。在轉錄結束時,拓撲異構酶將 DNA 放鬆回 B 型構象。
DNA分子的三級結構是由 DNA 的兩條鏈相互纏繞而成的。DNA 雙螺旋可以在空間中排列,形成鏈的三級排列。
通常情況下,DNA 的 Lk 約為 25,這意味著它處於欠旋狀態。然而,DNA 也可以被超螺旋化,形成兩個“欠旋”,它是由負超螺旋組成的。這就像單鏈DNA 的兩個“旋轉”和沒有超螺旋。這種螺旋和超螺旋旋轉之間的相互轉換在基因轉錄和調控中至關重要。
DNA 與組蛋白和非組蛋白結合形成染色質。由於DNA 中磷酸基團的負電荷,使其具有相對的酸性。這種負電荷與鹼性組蛋白基團結合。
最近的研究表明,活躍轉錄區域以組蛋白的特定修飾模式為特徵。對組蛋白修飾動力學的實驗表明,甲基化、磷酸化和乙醯化之間存在顯著的動力學差異。這表明這些修飾在基因表達模式中發揮著不同的作用。
組蛋白是蛋白質,DNA纏繞在其周圍形成染色質。染色質的基本單位是核小體,由2個H2A、H2B、H3和H4組蛋白八聚體以及147個鹼基對的DNA超螺旋構成。DNA的可及性受高階染色質結構的調節,這些結構可以透過核小體的堆積獲得。人們認為,組蛋白分子的N端尾部有助於染色質功能,因為它介導核小體之間的相互作用,並參與將非組蛋白募集到染色質中。N端尾部引導與染色質結合因子的相互作用,這被認為是調節染色質結構的驅動力。然而,修飾可能以其他方式發生,例如觀察到的核小體的展開或組裝以及它如何參與基因調控。希望這能解釋表觀遺傳的遺傳(方框1),即個體之間表型差異不能僅僅歸因於DNA差異,例如同卵雙胞胎。
表觀遺傳的遺傳是指基因活性的變化,這些變化不受DNA序列編碼的影響。這些變化包括磷酸化、甲基化、ADP-核糖基化、SUMO化和泛素化。這些修飾可以根據它們在活躍基因或沉默基因中的出現被認為是啟用的或抑制性的。研究表明,甲基化可能具有不同的結果,具體取決於組蛋白修飾的結合因子。核小體定位被發現對DNA序列有影響,可能有助於表觀遺傳的遺傳。[2]
DNA的結構變異主要歸因於
- 1) 脫氧核糖構象變化(共4種構象)
- 2) 磷酸脫氧核糖骨架中相鄰鍵的旋轉(C1-C3 和 C5-C6 之間)
- 3) C1'-N 糖苷鍵的自由旋轉(導致syn或anti構象)
由於空間位阻,核苷酸中的嘌呤鹼基在相對於脫氧核糖的兩個穩定構象中受到限制,稱為syn和anti。另一方面,嘧啶通常限於anti構象,因為糖和嘧啶C-2上的羰基氧之間存在空間干擾。
| A 型 | B 型 | Z 型 | ||
|---|---|---|---|---|
| 螺旋方向 | ||||
| 右手螺旋 | 右手螺旋 | 左手螺旋 | ||
| 直徑 | ||||
| 26 埃 | 20 埃 | 18 埃 | ||
| 每螺旋週期的鹼基對數 | ||||
| 11 | 10.5 | 12 | ||
| 每鹼基對的螺旋上升 | ||||
| 2.6 埃 | 3.4 埃 | 3.7 埃 | ||
| 鹼基相對於螺旋軸的傾斜角度 | ||||
| 200 | 60 | 70 | ||
| 糖的構象 | ||||
| C-3’ endo | C-2’ endo | 嘧啶為C-2’ endo,嘌呤為C-3’ endo | ||
| 糖苷鍵構象 | ||||
| Anti | Anti | 嘧啶為Anti,嘌呤為Syn |
Campbell and Reese's Biology, 7th Edition
Nelson and Cox's Lehninger Principles of Biochemistry, 5th Edition





