結構生物化學/有機化學/蛋白質
蛋白質分子包含由20種氨基酸序列組成的多肽鏈。這些氨基酸透過肽鍵連線在一起,肽鍵是由兩個氨基酸縮合,並消除水分子而形成的。蛋白質的功能取決於其三級結構。蛋白質傾向於摺疊成三維結構,這是由於氨基酸的序列。蛋白質還包含每個氨基酸的官能團。這些基團具有反應性,並有助於蛋白質功能。蛋白質還相互作用以及與其他大分子相互作用。蛋白質可以是剛性的或柔性的。這使得某些蛋白質可以存在於細胞的不同部位,例如細胞骨架或軟組織中。
酶是催化化學反應的蛋白質。酶透過降低開始該反應所需的活化能來加速生物系統中的反應。
激素是體內作為化學信使的蛋白質。這些蛋白質被髮送到身體的不同部位以傳送或接收資訊。激素在調節人體和保持體內穩態方面非常重要。一些蛋白質激素包括胰島素、生長激素、促黃體激素 (LH)、促卵泡激素 (FSH) 和促甲狀腺激素 (TSH)。這些蛋白質是糖蛋白激素的一部分。
轉運蛋白也用於運輸。例如,血紅蛋白是一種金屬蛋白(含有金屬作為輔因子的蛋白質),它在鐵的幫助下在紅細胞中轉運氧氣。
運動蛋白幫助將化學能轉化為機械能,這與生物體的肌肉運動有關。例如肌動蛋白和肌球蛋白。
保護性蛋白質透過釋放、製造抗體、抵抗和破壞異物來保護細胞。抗體是γ球蛋白。
結構性蛋白質有助於維持生物體中各種生物成分(如細胞和組織)的結構。膠原蛋白、彈性蛋白、α-角蛋白、硬蛋白[檢查拼寫]和絲素蛋白都是有助於生物體形成的蛋白質例子。
儲存蛋白質包含能量,可以在生物體的代謝過程中被消化。例子有雞蛋卵白蛋白和牛乳酪蛋白。
膜蛋白包括受體和膜轉運。細胞膜上的受體允許離子透過。這些阻止不需要的物體進入細胞。這些受體還決定細胞是否興奮以產生動作電位。膜轉運很重要,因為它允許離子、蛋白質和其他大分子穿過細胞膜。
外部蛋白 - 細胞外的蛋白質,存在於多細胞生物體中。
內部蛋白 - 位於細胞內部的蛋白質,執行細胞內需求的功能。
膜蛋白 - 嵌入膜雙層或膜邊緣的蛋白質,有助於細胞內相互作用。
病毒蛋白 - 通常是病毒的外殼
酶是加速反應速率的蛋白質。許多反應如果沒有酶的參與是無法發生的。

該圖顯示了酶的存在如何降低活化能,從而加速反應。有酶的反應可以比沒有酶的反應快100億倍。酶的工作速度受底物和酶濃度、溫度和pH的影響。
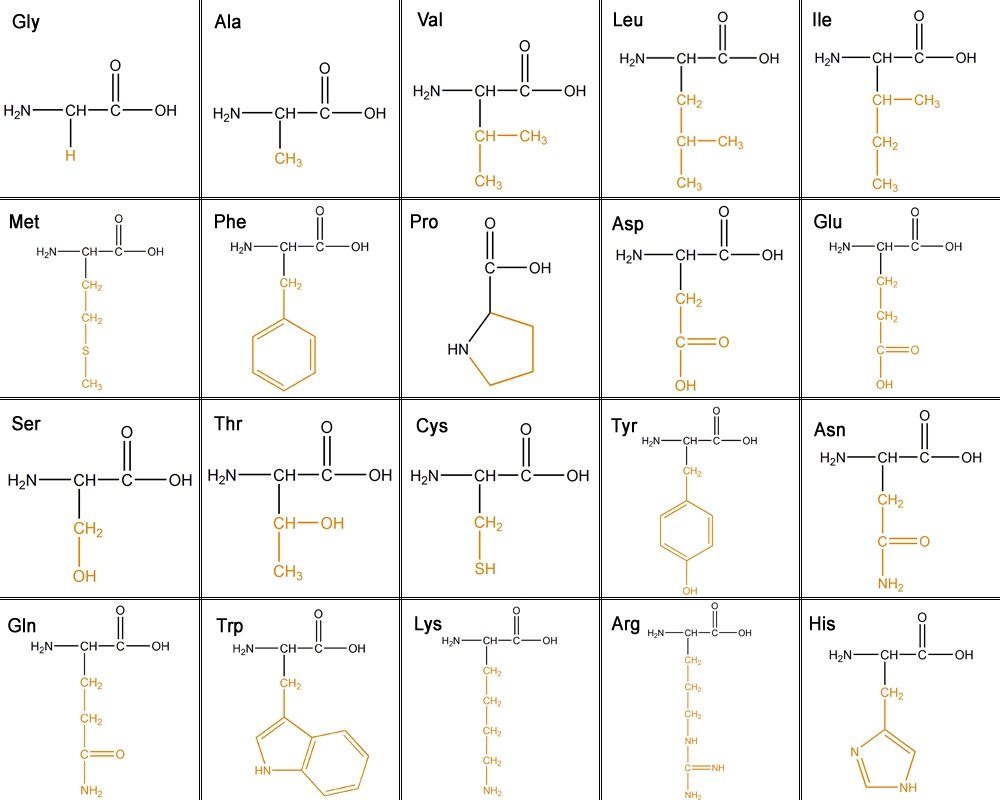
構成蛋白質的氨基酸有20種。主鏈具有一個N末端,即氨基基團 (NH2),和一個C末端,即羧基 (COOH)。側鏈使每種氨基酸獨一無二。
20種不同的氨基酸可以根據它們的側鏈(R基團)分為六類。
1. 脂肪族 - 碳側鏈。脂肪族鏈越長,疏水性越強。
甘氨酸、丙氨酸、纈氨酸、亮氨酸、異亮氨酸
2. 含羥基或硫 - OH具有反應性,親水(喜水),極性和不帶電荷。硫具有很強的反應性。
絲氨酸、蘇氨酸、半胱氨酸、蛋氨酸
3. 環狀 - 脯氨酸
4. 芳香族 -
苯丙氨酸 - 純粹疏水性
酪氨酸 - OH具有反應性
色氨酸 - 由於其NH基團,疏水性較低
5. 鹼性 - 親水性和帶正電荷。
賴氨酸、精氨酸、組氨酸
6. 酸性和其醯胺 - 帶負電荷。
天冬氨酸、穀氨酸、天冬醯胺、谷氨醯胺
這是氨基酸在其非離子化形式下的通用結構。
此表顯示了所有氨基酸及其側鏈。從左到右依次是:甘氨酸 (Gly)、丙氨酸 (Ala)、纈氨酸 (Val)、亮氨酸 (Leu)、異亮氨酸 (ILe)、蛋氨酸 (Met)、苯丙氨酸 (Phe)、脯氨酸 (Pro)、天冬氨酸 (Asp)、穀氨酸 (Glu)、絲氨酸 (Ser)、蘇氨酸 (Thr)、半胱氨酸 (Cys)、酪氨酸 (Tyr)、天冬醯胺 (Asn)、谷氨醯胺 (Gln)、色氨酸 (Trp)、賴氨酸 (Lys)、精氨酸 (Arg) 和組氨酸 (His)。
蛋白質由許多氨基酸組成。它們透過肽鍵連線在一起。肽鍵透過縮合反應形成,即失去一個水分子,以及羧基與氨基之間的反應。
上面的反應顯示了兩個丙氨酸如何透過肽鍵連線在一起。鍵是在n末端氨基和c末端羧基之間形成的。在這個反應中,兩個氫原子和一個氧原子被釋放出來,產生了水。由於羰基的共振,肽鍵幾乎像雙鍵一樣。因此,該鍵沒有旋轉,因此構象受到限制。這限制了立體化學,因為蛋白質中幾乎所有的肽鍵都是反式異構體,以限制R基團之間的空間位阻。只有脯氨酸可以是順式或反式,因為這兩種異構體所表現出的能量水平大致相同(脯氨酸的側鏈與相鄰R基團在兩種異構體中的距離相似)。原因是脯氨酸的側鏈與α-氨基形成一個環。脯氨酸是唯一側鏈與α-氨基形成環的氨基酸。
結構
蛋白質可以摺疊成四種不同的結構。這些結構決定了蛋白質的功能和特性。
一級結構 - 多肽的一級結構是指其氨基酸序列,從頭到尾。多肽的一級結構由基因決定。基因攜帶製造具有特定氨基酸序列的多肽的資訊。為了使蛋白質正常發揮功能,每個氨基酸都需要按基因分配的順序排列。即使氨基酸序列中發生微小的變化也會影響蛋白質的形狀及其功能能力。一個典型多肽的長度約為300個氨基酸,而一些基因編碼的蛋白質長度則在幾千個氨基酸左右。
二級結構 - 多肽的氨基酸序列,加上化學和物理定律,會導致多肽摺疊成更緊湊的結構。氨基酸可以在蛋白質內的鍵周圍旋轉。這就是蛋白質具有柔韌性並能摺疊成多種形狀的原因。摺疊可以是不規則的,或者某些區域可以具有重複的摺疊模式。這種重複模式稱為二級結構。兩種型別是α-螺旋和β-摺疊。在α-螺旋中,多肽主鍊形成一個重複的螺旋結構,該結構由氫鍵穩定。這些氫鍵以規律的間隔出現,導致多肽主鍊形成螺旋。在β-摺疊中,多肽主鏈的區域彼此平行排列。當這些區域形成氫鍵時,多肽主鍊形成一個重複的鋸齒形形狀,稱為β-摺疊。
三級結構 - 由於一級結構,二級結構開始建立,多肽摺疊並自身重疊以形成稱為蛋白質三級結構的複雜三維形狀。三級結構是單個多肽的三維形狀。它通常是構成多肽的氨基酸的R基團之間的相互作用的結果。對於一些蛋白質,例如核糖核酸酶,三級結構是功能性蛋白質的最終結構。其他蛋白質由兩個或多個多肽組成,並採用四級結構。三級結構在酶活性方面很重要。
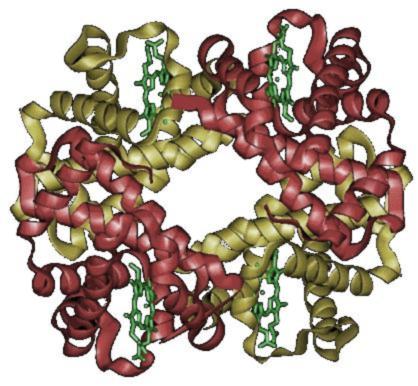
四級結構 - 大多數功能性蛋白質由兩個或多個多肽組成,每個多肽都採用三級結構,然後彼此組裝。單個多肽稱為蛋白質亞基。亞基可能是相同的多肽,也可能是不同的。每個亞基都有一個非蛋白質成分,這對蛋白質的正常功能必不可少。這些成分被稱為血紅素。當蛋白質包含多個多肽鏈時,它們被稱為具有四級結構,也被稱為多聚體蛋白質,意思是許多部分。
影響蛋白質結構的因素
[edit | edit source]有幾個因素決定了多肽如何採用它們的二級、三級和四級結構。多肽的氨基酸序列是區分一種蛋白質與另一種蛋白質結構的決定性特徵。當多肽在細胞中合成時,它們摺疊成二級和三級結構,這些結構組裝成大多數蛋白質的四級結構。如前所述,化學和物理定律以及氨基酸序列共同控制著這個過程。五個因素對於蛋白質摺疊和穩定性至關重要
1. 氫鍵
2. 離子鍵和其他極性相互作用
3. 疏水效應
4. 範德華力
5. 二硫鍵
影像顯示了兩個亞基,其中α亞基以紅色顯示,β亞基以黃色顯示。
最近,蛋白質結構空間的性質在文獻中得到了廣泛的討論。隨著越來越多的證據表明幾乎任何二級結構的排列都是可能的,並且整個蛋白質空間可以透過類似結構的路徑穿越,傳統上將蛋白質宇宙視為一組獨立摺疊的離散觀點受到了批評。我們認為,離散描述和連續描述不是相互排斥的,而是互補的:從進化的意義上說,空間在很大程度上是離散的,但在量化純粹的結構相似性時在幾何上是連續的。進化連線主要侷限於對應於摺疊的獨立結構原型,作為結構穩定性的島嶼,在島嶼之間只有少數可追蹤的連結。然而,對於幾何相似性度量,通常可以找到一個合理的臨界值,該臨界值會產生透過中間體連線任何兩個結構的路徑。
最近關於蛋白質結構空間起源的討論很多。研究人員一直在爭論蛋白質是由離散的結構組構成,還是一個連續體。傳統上對不同結構摺疊的看法受到了質疑,許多研究人員支援連續的看法。離散的觀點認為蛋白質是獨立的摺疊,而連續的觀點支援任何二級結構排列都可能的觀點。研究人員並沒有爭論哪種觀點是正確的,而是開始斷言連續和離散的觀點都代表了一種二元性,因為每個觀點都是必要的,並且存在於蛋白質結構空間中。離散和連續的觀點實際上是互補的,蛋白質結構空間在進化水平上是離散的,但在幾何上是連續的。透過將某些摺疊視為結構穩定性的島嶼來建立進化連線。為了檢視蛋白質結構的幾何相似性,我們看到了透過中間體連線任何兩個結構的路徑。
離散觀點
傳統的離散觀點是在蛋白質結構中存在許多結構相似性的理念下發展起來的。這個理念是透過利用 X 射線晶體學來研究最早的蛋白質結構,即肌紅蛋白和血紅蛋白而發展起來的。科學家發現肌紅蛋白和血紅蛋白儘管序列不同,但結構相似。蛋白質結構中結構相似性的其他例子包括胰凝乳蛋白酶和胰蛋白酶、幾個 TIM β/α 桶、羅斯曼摺疊和免疫球蛋白樣 β 三明治。所有這些結構都是獨一無二且可識別的。
“摺疊”的概念是用來描述蛋白質結構中的這種離散性。因此,新確定的結構可以被識別為這些清晰且可識別結構之一,或者可以用來建立一個“新的”摺疊,以便其他蛋白質結構在未來可以識別它。這個理念得到了大多數結構與這些常見的蛋白質結構原型相匹配這一事實的支援。
TIM 桶摺疊是原型的一個例子。大量的代謝酶屬於 TIM 桶摺疊原型。儘管這些家族中的大多數在序列方面沒有顯示出太多相似性,但 X 射線晶體學家在許多酶家族中發現了 TIM 桶。眾所周知,這些 TIM 桶家族是由基因重複和代謝途徑的積累產生的。
由邁克爾·羅斯曼發現的摺疊是另一個突出的結構原型的例子。這種雙重纏繞摺疊透過兩個右手βαβ單元被識別,這兩個單元以中心對稱的形式放置,在單元的第一條鏈之間形成氫鍵。
存在一個進化過程,即進化成一個熱力學穩定的結構。發生的突變透過避開熱力學穩定性而偏離進化過程。因此,這些突變的蛋白質被選擇淘汰。驅動進化的穩定選擇使得摺疊之間的移動變得不常見。如果我們從進化的角度看待蛋白質結構空間,蛋白質的離散性是它的特徵。
連續觀點
許多出版物表明結構空間是連續的。TM 評分等相似性度量使科學家能夠透過不超過七步來找到任何兩個結構之間的連線。
連續空間不是由進化造成的,而是由氫鍵形成規則以及二級結構的反平行和平行排列造成的。連續的蛋白質結構空間也不涉及傳遞性。連續觀點更多地涉及幾何形狀,幾何形狀也不具有傳遞性。
在一些出版物中,“摺疊”一詞受到質疑,因為將結構分類為不重疊的摺疊會導致遺漏不同摺疊中重要的功能性連線。
將常見結構與非常不同的幾何形狀分組對於分類和視覺化非常有用。使用這些分組,例如之前討論過的“TIM 桶”、“羅斯曼摺疊”和“OB 摺疊”,可能有助於確定結構和功能。另一方面,其他型別的“摺疊”可能更加模糊,並且只針對某個進化組。以不同α-螺旋摺疊的蛋白質為例。它們通常以螺旋堆積角度的漸進變化為特徵,而不是離散的拓撲差異。在這些模糊的情況下,連續觀點可能更合適。為了確定蛋白質功能,有必要研究結構相似性列表,而不僅僅是摺疊分配,因為即使對於具有不同摺疊的蛋白質結構,功能位點的放置和構象也可能是共同的。例如,TIM 桶和羅斯曼摺疊具有離散不同的幾何形狀,並且它們的活性位點在 β 鏈和 α 螺旋之間具有相似的位置。
“摺疊”是一個對 SCOP 分類(蛋白質結構分類)至關重要的術語,是建立蛋白質之間進化連線的標準。如果蛋白質具有相同的摺疊,則意味著它們具有相同的 major secondary structural elements,並且具有相同的相互方向和連線性。這種型別的分類可能會造成問題,因為選擇哪個二級結構是 major 的過程中涉及主觀性。
“摺疊”的定義更像是一種經驗性的近似“藝術”,因為蛋白質的分類標準非常寬鬆,並且基於以下幾點:結構資料、進化和功能考慮。
科學家現在正在使用一個修改後的術語,稱為“新摺疊”。使用這種案例,科學家很容易錯過蛋白質結構與進化和功能之間的有意義的聯絡。
科學家們質疑了蛋白質結構空間的直接和實際價值。它們從根本上說很重要,尤其是在結構預測中是必要的。連續觀點認為,如果存在大約 40% 的重疊結構,所有結構都是可預測的。這些觀點可以應用的另一種方式是預測功能特性。離散和連續的觀點都對蛋白質預測很有幫助。兩種觀點都適用於確定功能,因此不應該認為一種比另一種更重要,也不應該批評任何一種。
This idea of both continuous and discrete views playing a part in protein structure space suggests that there is a duality present in the nature of protein structure space. On an evolutionary standpoint, protein structure space is mostly discrete, and certain regions of stability correspond to certain protein folds. There are visible evolutionary connections between these regions. Geometrically speaking, the protein structure space is continuous. Any arrangement of secondary structures is possible, and almost any two structures can be connected by a path of intermediate and locally similar structures. An important note to remember about both discrete and continuous views is that homology is transitive, and homology is a property of discreteness; structure similarity is not. The continuous view is not transitive.
模型與結構
[edit | edit source]在蛋白質的研究和學習中,'結構'和'模型'之間存在混淆。模型經常與結構混淆,指的是基於分子相互作用(可以包括側鏈和鍵)、分子之間的同源性或一般推理的模型排列。它通常是用於指導模型構建的實驗中獲取的資料的一部分。模型可以非常簡單,也可以非常複雜。它可以包括代表 α 或 β 結構的箭頭,或者箭頭來顯示路徑。它們還可以顯示測量值的約束。
蛋白質的結構是指原子與其共價鍵和非共價鍵之間的空間相互作用。結構通常是透過使用 X 射線晶體學、電子顯微鏡、核磁共振等實驗獲得的。電子顯微鏡和晶體學提供了空間解析度的準確性,而核磁共振實驗提供了有關原子排列及其配位的資訊。[1]
蛋白質是在有機化學中製造、修飾和識別的。有機化學反應對於蛋白質的存在和功能是必要的。前面的部分討論了將蛋白質連線在一起的反應。生物化學和有機化學的一個重要部分是識別蛋白質和確定氨基酸的連線順序。識別這些序列允許與其他蛋白質進行比較。它們對於製造DNA和編碼基因也很有價值。以下技術涉及有機化學,有助於識別蛋白質的序列。
埃德曼降解
埃德曼降解確定 N 末端的氨基酸。試劑苯異硫氰酸酯用於裂解 N 末端氨基酸,同時保持其餘鏈完整。這對於識別短肽很有用。但是,如果鏈很長,確定序列將需要很長時間,因為它一次只能識別一個氨基酸。該方法的效率每次重複都會降低。因此,識別更長鏈的最佳方法是將它們分解成更小的肽進行分析。
化學裂解
溴化氰- CNBr 在蛋氨酸的羧基側裂解鏈
鄰碘醯基苯甲酸- 在色氨酸的羧基側裂解
羥胺- 裂解天冬醯胺- 甘氨酸鍵
2-硝基-5-硫氰酸苯甲酸酯- 半胱氨酸殘基的氨基側
酶促裂解
胰蛋白酶- 在賴氨酸和精氨酸的羧基側裂解
梭狀芽孢桿菌蛋白酶- 在精氨酸殘基的羧基側裂解
金黃色葡萄球菌蛋白酶- 天冬氨酸和穀氨酸的羧基側
凝血酶- 在精氨酸的羧基側裂解
胰凝乳蛋白酶- 在酪氨酸、色氨酸、苯丙氨酸、亮氨酸和蛋氨酸的羧基側裂解,主要是芳香側鏈
羧肽酶 A- 除精氨酸、賴氨酸或脯氨酸外,裂解 C 末端氨基酸的氨基側
蛋白質降解是一個重要的過程,它將蛋白質分解成更小的亞基氨基酸。降解發生是為了維持和為身體提供穩定的氨基酸量。錯誤摺疊或受損的蛋白質會被分解,因為它們毫無用處,必須被破壞。膳食蛋白質也會被降解。膳食蛋白質包含體內無法合成的氨基酸,因此必須透過我們所吃的食物來獲取。這些氨基酸被稱為必需氨基酸,是重新合成新蛋白質的重要組成部分。
蛋白質首先在胃中被消化,胃中的酸性條件為蛋白質變性提供了最佳環境。低 pH 值使蛋白水解酶能夠展開並降解蛋白質。胃蛋白酶是胃中發現的主要酶。蛋白質的進一步分解發生在腸腔中。胰腺是幫助分解蛋白質的蛋白水解酶的主要來源。泛素-蛋白酶體降解蛋白質是人體用來調節氨基酸供應的一種途徑。一種較小的蛋白質稱為泛素首先標記需要降解的蛋白質。這會在蛋白質上建立一個標記,訊號蛋白酶體進一步消化它。
蛋白質完全消化後,遊離氨基酸對應物透過血液運輸並傳遞到必要的組織,以被吸收並用於新的蛋白質合成。遊離氨基酸也可以在細胞呼吸過程中用作能量。氨基酸中的氨基必須首先被去除,以便碳骨架可以轉化為碳水化合物或脂肪酸。氨基透過尿素迴圈進行處理,其中氮被清除。
Berg,生物化學,第 6 版
http://faculty.clintoncc.suny.edu/faculty/michael.gregory/files/bio%20101/bio%20101%20lectures/biochemistry/biochemi.htm
[1] Fandrich,Marcus,Schmidt,Matthias 和 Grigorieff,Nikoaus:Trends Biochem Sci. 2011 年 6 月;36(6)338-345。“瞭解阿爾茨海默病 β-澱粉樣蛋白結構的最新進展”