結構生物化學/蛋白質/結構
以下是蛋白質一級結構的總結
一級結構
- 它是氨基酸的序列。
- 它是一個線性聚合物:將一個氨基酸的α-羧基與另一個氨基酸的α-氨基連線 => 肽鍵(共價鍵)。
- 在一些蛋白質中,線性多肽鏈是交聯的:二硫鍵。
一級結構是多肽,其中
- 肽中的每個氨基酸都是一個殘基
- 有一個規律重複的片段稱為主鏈或骨架,以及一個可變的部分,包含側鏈。
蛋白質的一級結構是具有一系列氨基酸的線性聚合物。這些氨基酸透過 C-N 鍵連線,也稱為肽鍵。肽鍵的形成產生水分子作為副產物,當一個氨基酸 N 端失去氫而另一個氨基酸 C 端失去 -羥基時。因此,多肽或多肽鏈,是一個描述眾多氨基酸之間多個連線的肽鍵的術語。多肽鏈中的每個氨基酸都是一個單元,通常稱為殘基。這些鏈具有平面骨架,因為肽鍵由於肽鍵形成的羰基碳和氮之間存在共振而具有雙鍵特性。每種蛋白質的一級結構都由特定的基因精確決定。氨基酸鏈中的 C-N 鍵具有雙鍵的特徵。該鍵具有短的鍵長且穩定。它不能旋轉。這種雙鍵特徵可以用結構來解釋,即氨基酸鏈中的 R 基團避免了空間衝突。
氨基酸透過肽鍵連線形成多肽鏈;每個氨基酸單元稱為殘基;由相同單元構建的多肽鏈稱為主鏈或骨架,以及一個變化的 R 基團,即側鏈。
蛋白質結構主要受疏水效應和極性殘基與其他型別鍵之間的相互作用控制。疏水效應是原始蛋白質結構的主要決定因素。蛋白質內部非極性側鏈的聚集受到熵增加的青睞,否則水分子將在疏水基團周圍形成籠子。疏水側鏈很好地表明瞭多肽鏈的哪些部分位於內部,與水性溶劑沒有接觸。氫鍵是蛋白質結構的中心特徵,但對蛋白質穩定性只有微小的貢獻。氫鍵透過從少量疏水穩定的構象中選擇蛋白質的獨特結構,微調三級結構。二硫鍵可以在蛋白質摺疊到其天然構象時在多肽鏈內和之間形成。金屬離子也可以起到在蛋白質內部交聯的作用。
1) 溫度
2) pH
極端溫度會導致多肽鏈展開,從而導致結構發生變化,通常會導致功能喪失。如果蛋白質作為酶發揮作用,變性會導致該蛋白質失去其酶活性。隨著包含蛋白質的溶液溫度升高,額外的熱量會導致鍵的扭曲和彎曲。當蛋白質開始變性時,蛋白質的二級結構會丟失並採用隨機捲曲構象。氨基酸側鏈之間的共價相互作用,例如二硫鍵,也會丟失。
在高或低 pH 水平下,蛋白質會由於質子的丟失或獲得而變性,因此會失去電荷或帶電,具體取決於 pH 變化的方向和幅度。這將消除維持蛋白質摺疊形狀所需的許多離子相互作用。結果,結構的變化會導致功能的變化或喪失。
在多肽被純化後,應確定多肽的組成。為了確定存在哪些氨基酸以及每種氨基酸的含量,整個鏈透過醯胺水解(6N HCl,1100C,24hr)降解,以產生所有遊離氨基酸殘基的混合物。透過氨基酸分析儀分離混合物並記錄其組成。氨基酸分析儀透過給出色譜圖來確定多肽的組成,色譜圖記錄序列中存在的每種氨基酸的峰值。然而,氨基酸分析儀只能給出多肽的組成,而不能給出氨基酸相互連線的順序。
為了確定氨基酸序列,通常從確定多肽的氨基末端開始。該過程被稱為埃德曼降解,所使用的試劑是苯異硫氰酸酯。

在埃德曼降解中,末端氨基與異硫氰酸酯試劑反應生成硫脲衍生物。用弱酸處理後,標記的氨基酸會轉化為苯硫代乙內醯胺,而其餘的多肽保持不變。由於所有氨基酸的苯硫代乙內醯胺都是已知的,因此可以很容易地確定原始多肽的氨基末端。但是,埃德曼降解只能用於識別多肽的氨基端;因此,對於由數百個氨基酸組成的多肽來說,它通常不是一種實用的方法。此外,多次降解迴圈會導致雜質積累,這將嚴重影響肽的產量。高產率意味著不是完全定量的,並且在每一步降解中,未完全反應的肽會與新肽混合,導致無法處理的混合物。
換句話說,二級結構指的是序列中相鄰氨基酸殘基的空間排列。α-螺旋和 β-鏈是二級結構的元素。
蛋白質的二級結構通常在構象上非常規則。它們是一級結構的空間排列。α螺旋和β摺疊片是兩種型別的規則結構。有趣的是,構成多肽的某些氨基酸實際上會偏好特定的摺疊結構。α螺旋似乎是預設結構,但由於立體因素等相互作用,某些氨基酸會更傾向於摺疊成β摺疊片等等。例如,纈氨酸、異亮氨酸和蘇氨酸等氨基酸在β碳上都有支鏈,這會導致α螺旋排列中的空間衝突。甘氨酸是最小的氨基酸,可以適應所有結構,因此它不特別偏好螺旋形成。因此,這些氨基酸主要出現在它們的側鏈可以很好地適應β構型的位置。
多肽主鏈的結構主要是氫鍵;每個殘基都有一個羰基,它是一個良好的氫鍵受體;氮-氫基團,一個良好的氫鍵供體。
α螺旋看起來像結構的外部。+右手出現在拉氏曼達圖的右下方
+ Left hand (LOOP): rare on the left top of Ramachandran plot
α螺旋的一般物理性質是


- 每圈3.6個殘基
- 平移(上升)1.5埃
- 旋轉100度
- 螺距(或高度)5.4埃(1.5埃*3.6個殘基)

- 螺旋方向 = 順時針(通常),因為它會受到更少的空間位阻
- 螺旋內部由盤繞的骨架組成,側鏈在螺旋陣列中向外突出
- 第一個羰基與第四個氨基上的氫之間的氫鍵
- α螺旋的簡寫圖是一個帶狀圖或棒狀圖


- α螺旋落在拉氏曼達圖的象限1(左手螺旋)和3(右手螺旋)內
I. 捲曲螺旋
α捲曲螺旋由兩個或多個相互交織的α螺旋組成,形成一個穩定的結構。這種結構為組織和細胞提供支撐,有助於細胞骨架和肌球蛋白和肌動蛋白等肌肉蛋白。α角蛋白由七肽重複序列(7個氨基酸序列的不完美重複)組成。這促進了兩個或多個螺旋之間的鍵合。
II. 膠原蛋白
膠原蛋白是另一種型別的纖維蛋白,由三個螺旋狀多肽鏈組成。它是哺乳動物中最豐富的蛋白質,構成皮膚、骨骼、肌腱、軟骨和牙齒的重要組成部分。皺紋也是由這種蛋白質的降解引起的。在膠原蛋白的結構中,多肽鏈中每三個殘基就有一個甘氨酸,因為它是唯一足夠小的殘基,可以適合超螺旋電纜的內部位置。與正常的α螺旋不同,每個膠原蛋白螺旋都透過脯氨酸和羥脯氨酸殘基的吡咯烷環的立體排斥來穩定。但是,三個交織的鏈透過氫鍵來穩定。
I. 基序
基序是二級結構的簡單組合,例如螺旋-轉角-螺旋,它由兩個由轉角隔開的螺旋組成。螺旋-轉角-螺旋基序通常存在於DNA結合蛋白中。
II. 結構域
結構域或緊湊的球狀體由多個基序組成。它們是透過轉角或環連線的兩個或多個緊湊區域摺疊的多肽鏈。它們的結構是球形的,這對蛋白質有利,因為它節省了空間。通常,球狀蛋白的內部由疏水性氨基酸組成,例如亮氨酸、纈氨酸、蛋氨酸和苯丙氨酸。外部由具有親水性趨勢的氨基酸組成,例如天冬氨酸、穀氨酸、賴氨酸和精氨酸。球狀蛋白的一個例子是肌紅蛋白,它是肌肉中的氧氣載體。它是一個非常緊湊的分子,僅由α螺旋(70%)組成,除了環和轉角(30%)。
研究跨膜和非跨膜螺旋的拓撲結構有助於解答有關膜蛋白插入的許多問題。特別是,研究拓撲結構的序列和脂質依賴性可以提供對翻譯後拓撲結構變化的見解。此外,研究拓撲結構已導致設計具有生物醫學應用的疏水螺旋。例如,已設計出一種名為pHLIP肽的腫瘤標記物。
不同的測試已被用於顯示對疏水螺旋的不同影響。例如,色氨酸和酪氨酸等親水殘基會破壞跨膜狀態。親水結構域不能穿過膜,因此會阻斷任何跨膜和非跨膜平衡。此外,帶電的離子化殘基也會破壞跨膜狀態。在螺旋-螺旋相互作用中也實現了跨膜的穩定。此外,陰離子脂質會促進疏水性肽和蛋白質的膜結合。
α螺旋、β鏈和轉角是由氨基酸之間肽 N-H 和 C=O 基團之間的規律氫鍵模式形成的,這些氨基酸線上性序列中彼此靠近。這種摺疊片段被稱為二級結構。
α螺旋由一條多肽鏈組成,其中氨基(N-H)與距離 4 個殘基的羧基(C=O)形成氫鍵。α螺旋是一種棒狀結構。鏈的緊密盤繞的骨架形成棒的內部,側鏈在螺旋陣列中向外延伸。這會導致一個順時針捲曲結構,被稱為“右手”螺旋方向。這種摺疊模式以及β摺疊片實際上是由萊納斯·鮑林和羅伯特·科裡在人們實際看到它之前半個世紀提出的。大多數α鏈位於拉氏曼達圖的左下角或右上角。本質上,大多數α螺旋存在於右手螺旋區域。α螺旋特別適合跨膜蛋白,因為肽骨架的所有氨基氫和羰基氧原子都可以相互作用形成鏈內氫鍵,而它的脂肪族側鏈可以在細胞膜的疏水環境中穩定。
丙氨酸、亮氨酸和穀氨酸(在生理 pH 值下以穀氨酸形式存在)是α螺旋中最常見的殘基。
蛋白質的α螺旋含量範圍很廣,從無到接近 100%。
一般來說,α螺旋是多肽鏈的“正常”形狀;然而,某些氨基酸的特徵會破壞α螺旋形成,反而有利於β鍊形成。在β碳上具有支鏈的氨基酸(即纈氨酸、蘇氨酸和異亮氨酸)是有問題的,因為它們會擁擠肽骨架。連線到β碳的 H 鍵受體/供體基團(即絲氨酸、天冬醯胺和天冬氨酸)可以與骨架胺和羧基基團鍵合,再次干擾α螺旋形成。
雖然單個氨基酸可能偏向於一種形式或另一種形式,但即使是短的(<7 個氨基酸)肽鏈的二級結構的預測也只有 60-70% 的準確率。這種可變性表明其他因素,例如與鏈中更遠處的氨基酸的三級相互作用,會影響其摺疊成觀察到的三級結構。
β鏈是
- 大約 ʊ = 120° 和 ϕ = -120°
- 你有角度,你就能形成之字形
之字形結構中氨基酸之間的距離是 3.5 埃
與α螺旋結構形成對比的是,β摺疊是由多條多肽鏈透過氫鍵連線形成的片狀結構。氫鍵形成於兩條不同鏈之間的 NH 和 CO 基團之間,而並非在同一條鏈內,這與α螺旋結構形成的氫鍵不同。由於其通常呈波紋狀或褶皺狀外觀,這種二級結構構象被稱為β摺疊片。β鏈可以以平行、反平行或混合(平行和反平行)方式排列。

反平行構象是最簡單的構象。相鄰多肽鏈的 N 端和 C 端彼此相反,這意味著一條肽鏈的 N 端與相鄰鏈的 C 端對齊。在反平行構象中,每個氨基酸與相鄰鏈中的一個氨基酸線性鍵合。

平行排列發生在相鄰多肽鏈沿相同方向延伸時,這意味著肽鏈的 N 端和 C 端對齊。結果,一個氨基酸不能像在反平行構象中那樣直接鍵合到相鄰鏈中互補的氨基酸。相反,來自一條鏈的氨基與相鄰鏈上的羰基鍵合。來自初始鏈的羰基然後與相鄰鏈上兩個殘基之前的氨基形成氫鍵。平行構象中氫鍵的扭曲會影響氫鍵的強度,因為氫鍵在平面時最強。因此,由於氫鍵的這種扭曲,平行β摺疊不如反平行β摺疊穩定(例如,形成少於 5 個殘基的平行β摺疊非常罕見)。
β鏈的側鏈交替排列在鏈的相對兩側。β鏈中氨基酸之間的距離為 3.5 Å,這比α鏈中 1.5 Å 的距離更長。因此,β摺疊比α螺旋更靈活,可以是扁平的,也可以是略微扭曲的。蛋白質中β摺疊的平均長度為 6 個氨基酸殘基。實際長度範圍從 2 到 22 個殘基。

在拉曼圖中,β摺疊位於左上角象限。這對應於 ψ 角為 0° 到 180°,Φ 角為 -180° 到 0°。

在 3D 模型中,β摺疊的視覺表示通常用一個指向鏈方向的扁平箭頭表示。
環狀結構很重要,但α螺旋和β鏈才是蛋白質二級結構的關鍵。它們與蛋白質的二級結構有關。
多肽鏈可以透過形成反向轉角和環狀結構來改變方向。α螺旋和β鏈透過這些轉角和環狀結構連線在一起。大多數蛋白質具有緊湊的球狀形狀,這是由於多肽鏈方向的逆轉,這使得多肽可以摺疊回自身。在許多反向轉角中,多肽鏈中殘基 i 的 CO 基團與殘基 i+3 的 NH 基團形成氫鍵。轉角有助於穩定多肽鏈中突然的方向變化。環狀結構是更復雜的鏈反轉結構,它們是剛性的且定義明確。環狀結構和轉角通常位於蛋白質的表面,因此它們通常參與蛋白質與其他分子的相互作用。在環狀結構中,沒有像螺旋或β鏈中那樣的規則結構。
關於轉角在蛋白質摺疊中的作用,已經提出了兩種假設。一種觀點認為,轉角透過將規則二級結構元件之間的相互作用聚集在一起,在摺疊中起著至關重要的作用。這種觀點得到了誘變研究的支援,這些研究表明特定殘基在某些蛋白質的轉角中起著至關重要的作用。此外,轉角中 X-脯氨酸肽鍵的非天然異構體可以完全阻斷某些蛋白質的構象摺疊。在相反的觀點中,轉角在摺疊中起著被動作用。這種觀點得到了大多數轉角中觀察到的氨基酸保守性差的支援。此外,轉角中許多 X-脯氨酸肽鍵的非天然異構體對摺疊幾乎沒有或根本沒有影響。
當二級結構元件以特定的幾何排列組合時,就形成了一個基序。β髮夾轉角是一種排列方式;它們是最簡單的結構之一,存在於球狀蛋白質中。在轉彎後,反平行鏈可以透過羰基碳與肽主鏈氮之間的氫鍵有效地結合。研究表明,70% 的 β 髮夾長度小於 7 個殘基;大多數長度為 2 個殘基。有兩種型別的雙殘基 β 髮夾轉角。第一種,I 型,形成左手 α 螺旋構象。這種左手構象由於上述氨基酸的性質,具有正的 φ 角。甘氨酸沒有側鏈來立體干擾轉折的氨基酸序列。天冬醯胺和天冬氨酸都能很容易地與羰基氧形成氫鍵,作為氫鍵受體。I 型轉角中的第二個氨基酸通常是甘氨酸,因為使用任何具有側鏈的氨基酸都會導致空間位阻。在 II 型 β 髮夾轉角中,第一個殘基只能是甘氨酸,因為存在空間位阻。然而,第二個殘基通常是極性的,例如絲氨酸或蘇氨酸。
纖維狀蛋白質,如 α-角蛋白和膠原蛋白,由兩個右手 α 螺旋相互纏繞形成一種稱為 α 捲曲螺旋的左手超螺旋。這種蛋白質中的兩個螺旋通常透過弱相互作用(如範德華力力和離子相互作用)相互交聯。側鏈相互作用可以每隔七個殘基重複一次,形成七肽重複序列。另一種形式的纖維狀蛋白質,膠原蛋白,存在於三個螺旋狀多肽鏈中。這些鏈相對較長,約 1000 個殘基,由於擁擠,每三個殘基出現一次甘氨酸。雖然螺旋透過空間斥力穩定,但三條鏈透過氫鍵穩定。這些蛋白質通常在生物體中起結構作用,α-角蛋白通常存在於細胞的細胞骨架中,以及某些肌肉蛋白中。膠原蛋白通常存在於牙齒、皮膚和肌腱中。
預測多肽鏈將構象成哪個二級結構組(α-螺旋、β-摺疊片/鏈或轉角/環狀結構)的科學並不特別精確。然而,某些氨基酸的二級結構形成頻率在實際科學實驗中已被記錄,這些值可以使科學家根據蛋白質的氨基酸組成預測蛋白質的摺疊,準確率約為 60-70%。六個或更少殘基的片段通常可以用這種準確率預測。儘管某些氨基酸傾向於摺疊成其優選的構象,但當然也存在例外,因此二級結構預測並不總是準確的。三級相互作用,即與彼此相距更遠的殘基之間的相互作用,也可以決定摺疊結構。每個氨基酸都對二級結構有一種偏好,但通常它對一種結構的偏好只是略微大於另一種結構,因此,不幸的是,這並不意味著什麼。氨基酸可以在一種蛋白質中出現在α螺旋中,而在另一種蛋白質中出現在β摺疊片中。由於基於氨基酸序列的二級結構的不可預測性,二級結構正在與相似家族的序列進行比較和預測。
在二級結構預測研究中,歷史上出現了各種技術。藉助計算機,預測一直是生物資訊學中一個被追求的研究課題,並且許多方法仍在不斷提出。在萊納斯·鮑林和羅伯特·科裡於 1951 年發現蛋白質中的週期性 α 螺旋和 β 摺疊片結構之後,蛋白質結構預測的進一步闡明開始發展。二級結構預測中的一種主要方法是Chou-Fasman 方法;它的準確率為 50-60%。這種方法基於為特定氨基酸殘基分配一組預測值,然後對該值應用演算法。此後不久,對該方法進行了進一步改進,即GOR 方法,它是在 20 世紀 70 年代後期開發的,並利用了資訊理論|熵和資訊概念來進行二級結構預測。當該方法被設計出來時,其準確率約為 65%,但是,也對該方法進行了改進。存在一些演繹技術,其中在已識別蛋白質中找到相似序列。這種方法是透過讓計算機軟體搜尋已識別蛋白質的資料庫來實現的。與之相反的是從頭算方法,該方法在不檢視相似殘基序列的情況下構建三維模型。這種方法基於氫鍵原理和定位。
摺疊預測的其他方法和因素包括分析氨基酸側鏈的基本化學趨勢,以確定其在二級結構中的偏好。α-螺旋被認為是預設結構,因此破壞α-螺旋的氨基酸通常存在於β摺疊片或環狀結構和轉角中。例如,纈氨酸、蘇氨酸和異亮氨酸由於 β 碳的支化,通常會破壞螺旋。這三個氨基酸殘基更常見於β摺疊片中,它們的側鏈會位於與主鏈不同的平面上。還有一些氨基酸殘基既不偏好α-螺旋也不偏好β摺疊片,例如,脯氨酸的 φ 角受限於約 60° 度,並且沒有 NH 基團,所有這些都是由於它是有環的。這會破壞α-螺旋和β摺疊片,因此它主要存在於環狀結構和轉角中。一個反直觀的例子是甘氨酸,根據其較小的尺寸,理論上它可以很容易地適應任何結構,但實際上它也傾向於避免α-螺旋和β摺疊片。摺疊也肯定依賴於側鏈之間的化學相互作用,因此周圍的氨基相互作用也會影響摺疊趨勢。這些趨勢反映在單個氨基酸的二級結構頻率中。
以下是特定氨基酸二級結構的相對傾向
α-螺旋:Glu、Ala、Leu、Met、Lys、Arg、Gln、His
β-摺疊:Val、Ile、Tyr、Cys、Trp、Phe、Thr
轉角和環:Gly、Asn、Asp、Pro、Ser
扭轉角
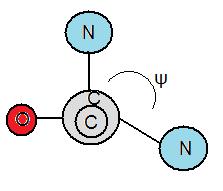
[edit | edit source]扭轉角也稱為二面角。扭轉角是原子之間鍵的度數測量。蛋白質的摺疊受氨基鍵旋轉度的影響。多肽鍵中存在兩種不同型別的扭轉角。Phi, φ 是肽鍵的 α-碳原子和氮原子之間的角度。另一個鍵稱為psi, ψ,它是 α-碳原子和羰基之間的角度。為了測量 φ,必須從氮原子朝向 α-碳原子看,以測量角度是負的還是正的。如果 α-碳原子逆時針旋轉,則角度為負,反之亦然。此外,為了測量 ψ,必須從氮原子朝向羰基看。同樣,如果羰基逆時針旋轉,則角度為負,反之亦然。
Ramachandran 圖
[edit | edit source]由 Gopalasamudram Ramachandran 建立的Ramachandran 圖有助於確定氨基酸是否會形成 α-螺旋、β-摺疊、環或轉角。Ramachandran 圖被分為四個象限,以角度 ϕ 為 x 軸,以角度 ψ 為 y 軸。扭轉角的組合會將氨基酸置於特定象限中,從而確定它是否會形成 α-螺旋、β-摺疊、環或轉角。那些在象限 1 和 3 中連續出現幾次的氨基酸會形成 α-螺旋,而那些在象限 2 中重複出現的氨基酸會形成 β-摺疊。象限 4 通常是不利的,因為存在空間位阻。此外,它在大多數情況下是不可能的,因為象限 4 中的扭轉角組合無法存在,因為它們會導致氨基酸原子之間發生碰撞。如果氨基酸落在不同的象限中,並且沒有重複,那麼它們就會成為環或轉角。此外,空間排斥原理指出,兩個原子不能同時佔據同一個位置。
肌紅蛋白是三級結構的一個例子。肌紅蛋白是一個極其緊湊的分子。它是肌肉中的一種氧氣載體,是一個包含 153 個氨基酸的單一多肽鏈。肌紅蛋白結合氧氣的能力取決於血紅素的存在,血紅素是一個非多肽輔基,由原卟啉 IX 和一箇中心鐵原子組成。
三級結構
[edit | edit source]蛋白質的三級結構是蛋白質的三維結構。這種三維結構主要由氨基酸序列決定,氨基酸序列由蛋白質的一級結構表示,但氨基酸序列不能完全預測三維結構的形成方式。影響三級結構最終形狀的另一個因素是蛋白質合成所處的環境。三級結構由蛋白質骨架中疏水氨基酸殘基的序列穩定。內部由疏水側鏈組成,而表面由與水性環境相互作用的親水氨基酸組成。
三級結構是由各種氨基酸側鏈之間的相互作用形成的,特別是兩個半胱氨酸基團之間形成的二硫鍵。在這個階段,一些蛋白質已經完成,而另一些蛋白質則結合了多個多肽亞基,從而形成了四級結構。
成核-凝聚模型。三級摺疊過程非常有條理,有關鍵的中間體。當蛋白質開始摺疊時,蛋白質的區域性區域首先開始摺疊。然後,各個區域性摺疊結合在一起完成三級結構。關鍵的概念是,當達到正確的摺疊時,這種摺疊會保留下來,直到蛋白質的所有其他部分也正確摺疊。這種摺疊過程遵循推理,因為隨機的試錯摺疊過程不僅需要更長的時間才能完成,而且還需要更多的輸入能量。
三級結構是指序列中相距很遠的氨基酸殘基的空間排列,以及二硫鍵的模式。三級結構也是最重要的蛋白質結構,用於確定蛋白質的酶活性。
結構
[edit | edit source]

半胱氨酸是一種含有硫醇基的氨基酸,它負責將三級結構連線在一起的二硫鍵。在三級結構中,當兩個螺旋結合在一起時,它們可能透過這些二硫鍵連線。含有較少二硫鍵的三級結構會形成更不剛性的結構,這些結構是靈活的,但仍然牢固,並且可以抵抗斷裂,例如頭髮和羊毛。而含有更多由半胱氨酸殘基形成的交聯二硫鍵的三級結構會導致更強、更硬、更堅固的結構,例如外骨骼。包含更多二硫鍵的蛋白質的其他例子包括爪子、指甲和角。
在生物體中可以找到由兩個 α-螺旋(如角蛋白)構成的結構。免疫球蛋白,也稱為抗體,是全 β-摺疊蛋白結構的一個例子。它由大約 7 個反平行 β-摺疊組成,排列成 2 個 β-摺疊。例如,如果將半胱氨酸突變為另一個氨基酸,它可以編碼為不同的蛋白質,從而導致錯誤摺疊。
域
[edit | edit source]一些多肽鏈摺疊成幾個緊湊的區域。多肽鏈中的這些區域稱為域,通常範圍為 30 到 400 個氨基酸。平均而言,域包含大約 100 個氨基酸。每個域形成自己的三級結構,這有助於蛋白質的整體三級結構。這些域是獨立穩定的。穩定是由金屬離子或二硫鍵引起的,這些離子或二硫鍵導致多肽鏈摺疊。不同的蛋白質可能具有相同的域,即使它們的整體三級結構不同。
有四種類型的域
- 全 α 域 - 純粹由 α-螺旋組成的域。
- 全 β 域 - 純粹由 β-摺疊組成的域。
- α+β 域 - 由 α-螺旋和 β-摺疊組成的域。
- α/β 域 - 由 α-螺旋和 β-摺疊組成的域,以 β,α,β 的方式層疊,一個 α-螺旋夾在 2 個 β-摺疊之間。
突變
[edit | edit source]為了使蛋白質發揮功能(除了食物中的蛋白質之外),它必須具有完整的三級結構。如果蛋白質的三級結構被破壞,則稱其為變性。一旦蛋白質變性,它將無法執行其預定的或原始功能。三級結構改變的主要原因是編碼蛋白質的基因發生突變。基因中的突變會導致多米諾骨牌效應,最終導致三級結構降解。降解會導致多種疾病,其中一種稱為囊性纖維化。囊性纖維化是由基因突變引起的,該基因稱為囊性纖維化跨膜傳導調節因子 (CFTR)。這種疾病會導致外分泌腺過度分泌粘液。最常見的是,囊性纖維化患者在 20-30 歲之前就會因肺功能衰竭而死亡。 尿崩症、家族性高膽固醇血癥和成骨不全症也是由蛋白質降解引起的疾病。三級結構本身的突變,而不是核苷酸序列的突變,也會導致疾病。這種突變的蛋白質也會聚集併成為不溶性沉積物,稱為澱粉樣蛋白,從而失去功能。常見的一種突變是疏水 R 基團在疏水環境中摺疊到內部,而不是外部。遺傳性阿爾茨海默病是一種由三級結構突變引起的疾病。另一種疾病包括瘋牛病,它是由 α-螺旋(可溶)突變為 β-摺疊(不溶並引起澱粉樣蛋白沉積)引起的。 [1]
摺疊
[edit | edit source]蛋白質的摺疊取決於一級結構中確定的氨基酸序列。它也取決於摺疊發生的環境。在疏水環境中,蛋白質的氨基酸的疏水側鏈會向外摺疊,而親水側鏈會向內摺疊,反之亦然,對於親水環境來說。在一個疏水環境中摺疊的蛋白質的一個例子是孔蛋白。它的親水側鏈摺疊在內部,從而為水創造了一個通道。具有非極性/疏水側鏈的氨基酸,如亮氨酸、纈氨酸、甲硫氨酸、苯丙氨酸和異亮氨酸,會在疏水環境中摺疊蛋白質時向外摺疊。同樣,在親水環境中,具有極性側鏈的氨基酸,如谷氨醯胺和天冬醯胺,會向外摺疊,而疏水側鏈會向內摺疊。
蛋白質的三級結構透過X射線晶體學和核磁共振(NMR)光譜學來確定。X射線晶體學是第一個用於確定蛋白質結構的方法。X射線晶體學是最好的方法之一,因為X射線的波長與蛋白質中發現的共價鍵的波長相似,從而可以更清晰地視覺化分子的結構。分析電子對X射線的散射來確定蛋白質的結構。為了使用X射線晶體學,所討論的蛋白質必須以晶體形式存在。一些蛋白質容易結晶,而另一些則不然。對於那些不容易結晶的蛋白質,必須使用核磁共振(NMR)光譜學來確定其結構。核磁共振光譜學利用具有磁偶極子和化學位移的原子核的自旋來確定分子的相對位置。
血紅蛋白是四級結構的一個例子。血紅蛋白是血液中的一種攜氧蛋白,由兩種型別(分別稱為α和β)的兩個亞基組成。

四級結構指的是透過分子間相互作用結合在一起的兩個或多個多肽鏈,形成一個多亞基複合物。將這些摺疊的蛋白質分子結合在一起的相互作用包括二硫鍵、氫鍵、氫鍵相互作用、疏水相互作用相互作用和倫敦力。這些力通常由肽的側鏈傳遞。
這些多肽鏈是蛋白質的亞基,能夠參與多種功能,例如作為酶催化劑,在細胞的細胞骨架中提供結構支援,甚至構成我們頭上的頭髮。
蛋白質的肽可以相同也可以不同。胰島素是包含兩個相同肽的二聚體,而血紅蛋白是包含兩個相同α亞基和兩個相同β亞基的四聚體。
在命名四級結構時,使用亞基(三級結構)的數量和字尾-mer(希臘語表示“部分,亞基”)
模式繼續使用pent-、hex-、hept-、oct-等。

- 胰島素
- 二聚體 - α鏈和β鏈
- 透過2個二硫鍵連線
- HIV蛋白酶
- 二聚體
- 由相同的亞基組成
- 膠原蛋白
- 由3個螺旋狀多肽鏈組成
- 甘氨酸出現在每三個殘基處,因為螺旋中心沒有空間
- 透過脯氨酸和羥脯氨酸殘基的吡咯烷環的位阻排斥穩定
- 氫鍵將膠原蛋白纖維的鏈結合在一起

- 血紅蛋白
- 由2個α和2個β組組成
- 呈球形
- 具有反向轉角,有助於蛋白質的圓形形狀
- 水通道蛋白
- 由6個α螺旋組成
- 形成疏水環
- 在細胞膜中形成四聚體,每個單體充當水通道
蛋白質的四級結構可以透過破壞將蛋白質結合在一起的共價和非共價力而變性。熱量、尿素或鹽酸胍會透過破壞非共價力而使蛋白質變性,而β-巰基乙醇會透過還原橋樑而破壞二硫鍵。
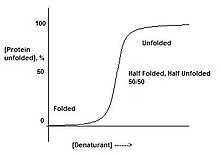
蛋白質要麼摺疊,要麼不折疊。不存在蛋白質“半摺疊”的階段。這可以透過慢慢地向蛋白質中新增變性劑來觀察。這將導致從摺疊狀態到未摺疊狀態的急劇轉變,表明僅存在這兩種形式。這是協同轉變的結果。
例如,如果將蛋白質放入僅蛋白質的一部分不穩定的變性劑中,整個蛋白質將展開。這是由於多米諾骨牌效應,其中使蛋白質的一部分不穩定將反過來使結構的其餘部分不穩定。當蛋白質處於對應於摺疊和未摺疊之間轉變中間的條件時,存在50/50的摺疊和未摺疊蛋白質混合物,而不是“半摺疊”蛋白質。
在討論了處於一種結構或另一種結構之後,它們之間在原子水平上一定存在一些東西。不幸的是,這是一個仍在開發中的領域,還有許多研究正在進行。凝聚成核原理等理論關注蛋白質摺疊的這個領域。
四級結構的性質
- 多肽鏈可以組裝成多亞基結構
- 指的是亞基的空間排列及其相互作用的性質
如果將課堂上的每個學生視為一個不同的氨基酸,每個右手視為一個α-羧基基團,每個左手視為一個α-氨基基團,而頭部視為R基團;那麼透過將右手連線到左手,該班將形成一個多肽。“連線”手的“鍵”將是肽鍵。這可以被認為是蛋白質的一級結構。
然後,如果將學生“吸引”到其他相隔4個“鍵”的學生,那麼這種結構將摺疊成二級結構;即α-螺旋。如果將學生排成線,並將他們吸引到另一條線中相應的學生,他們將形成β-摺疊片。
現在想象一下,頭部或R基團在諸如個性或極性等方面有所不同,例如,相似相吸。性格更合得來的學生會聚在一起,例如,疏水區域通常會聚集在一起,並在周圍被親水區域包圍。這構成了三級結構。
現在新增一個不同的類別,這個類別中的人會有他們自己的三級結構,這些新的人會進入並與原始類別發生反應,形成四級結構。
控制四級結構目前越來越引起學術界的興趣。操縱蛋白質組裝體有很多優勢。首先,人們能夠生長/合成對人類有益的酶。然而,使這些酶發揮作用是困難的部分。例如,固氮酶,能夠將氮氣固定為氨的酶,只能在有氧環境下與 ATP 作為能量來源一起發揮作用。此外,研究人員發現,固氮酶是由兩種蛋白質組成的,一種用於 ATP 耦合電子來源,另一種是固氮的反應中心。這兩種蛋白質組裝在一起作為整體發揮作用。最近,科學家們去除了 ATP 耦合蛋白,並用釕配合物取代了它。事實證明,釕配合物可以在光照下提供電子。現在,科學家們不必處理耦合 ATP 的複雜化學反應,只需照射改造後的固氮酶即可使其發揮作用!其次,蛋白質組裝體可以有很多臨床/材料應用。鐵蛋白是一個高階蛋白質組裝體家族,通常是 12 聚體或 24 聚體。先前的研究表明,它可以吸收大量的 Fe 離子。許多研究人員正在努力控制鐵蛋白的締合和解離,尋找藥物輸送、氣體儲存、金屬回收等的解決方案。已經開發出許多方法來控制蛋白質組裝。其中一些包括以下內容
1. 過渡金屬導向。蛋白質中的金屬中心很重要,不僅因為它們是反應中心,而且它們透過配位幫助穩定蛋白質的形狀。許多氨基酸本身就是配體。半胱氨酸、組氨酸、賴氨酸是常見的。此外,研究人員可以透過半胱氨酸替換將無機配體工程化到蛋白質中。因此,引入無機配體極大地擴充套件了蛋白質組裝的範圍。


金屬-配體鍵具有多種特性。最明顯的是,它是一種強相互作用。它比氫鍵強,但比共價鍵弱。因此,金屬-配體鍵很強,但又不那麼強,以至於仍然是可逆的。從空間上講,金屬具有其配位方向,主要是八面體和四面體。這種性質為人類在空間上排列蛋白質提供了極大的便利。


2. 疏水相互作用。在水性環境中,具有疏水側鏈的氨基酸傾向於聚集在一起,以最大程度地減少與水的接觸。研究人員利用這種特性,將特定匹配的一對非極性氨基酸工程化到蛋白質中,以獲得水溶液中的蛋白質寡聚體。
3. 鹽橋。眾所周知,氨基酸具有不同的 pI。因此,在特定 pH 值下,某些氨基酸帶負電荷,而另一些帶正電荷。如果蛋白質上的一個區域主要由帶負電荷的氨基酸佔據,而另一個區域由帶正電荷的氨基酸佔據,則蛋白質可以透過靜電吸引聚集。然而,這種技術通常不是那麼具有選擇性。
正在研究更多指導蛋白質組裝的技術,例如螺旋-螺旋。人類控制四級結構的潛力很有希望。